* 나트륨 이온의 한 몰 (na+)
* 클로라이드 이온의 한 몰 (cl-)
이것은 다음 방정식으로 표시됩니다.
NaCl (S) → Na + (aq) + Cl- (aq)
이유는 다음과 같습니다.
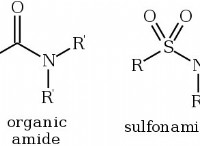
* 이온 성 화합물 : 염화나트륨은 이온 성 화합물이며, 이는 양으로 하전 된 나트륨 이온 (Na+)과 음으로 하전 된 클로라이드 이온 (Cl-) 사이의 정전기 인력에 의해 형성된다는 것을 의미한다.
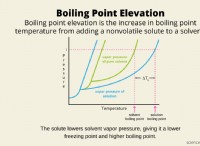
* 물에 용해 : NaCl이 물에 용해 될 때, 극 물 분자는 이온을 둘러싸고 그들 사이의 정전기 인력을 약화시킨다. 이를 통해 이온이 물 분자로 분리되어 둘러싸여 수화 된 이온을 형성 할 수 있습니다 (AQ) 기호로 표시).
* 화학량 측정법 : 화학적 공식 NaCl은 1 몰의 염화나트륨이 하나의 나트륨 이온과 1 몰의 클로라이드 이온을 함유 함을 나타낸다.
따라서, 하나의 NaCl이 물에 분리되면, 각 이온의 한 몰을 용액으로 방출합니다.