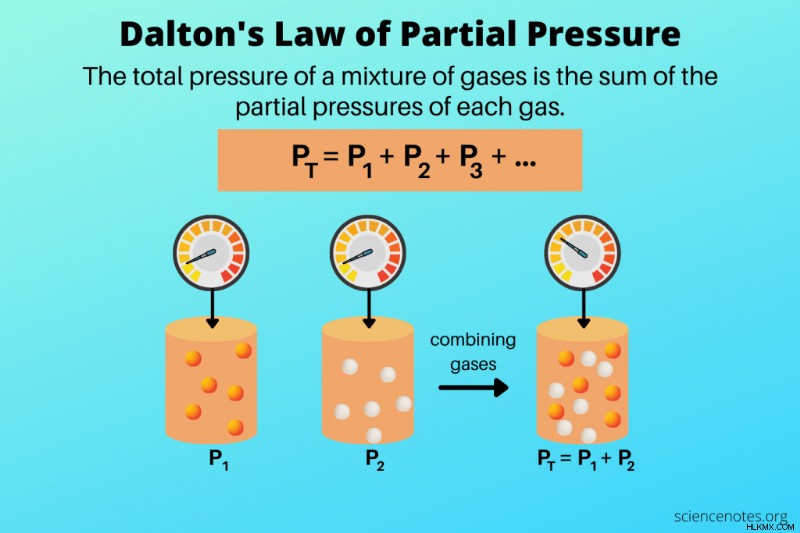
Dalton의 부분 압력 법칙 가스 혼합물의 총 압력은 각 가스의 부분 압력의 합과 같다고 말하는 이상적인 가스 법칙입니다. 영국 과학자 존 달튼 (John Dalton)은 1801 년 가스의 행동을 관찰하고 1802 년에 가스 법을 발표했다. 달튼의 부분 압력 법칙은 이상적인 가스를 설명하지만 실제 가스는 대부분의 조건에서 법을 따릅니다.
.dalton 's Law Formula
Dalton의 법칙에 대한 공식은 가스 혼합물의 압력이 성분 가스의 부분 압력의 합계라고 말합니다.
p t =p 1 + p 2 + p 3 +…
여기, p t 혼합물의 총 압력 및 p 1 입니다 , p 2 등은 개별 가스의 부분 압력입니다.
부분 압력 또는 두더지 분획에 대한 해결
Dalton의 법칙을 이상적인 가스 법칙과 결합하면 부분 압력, 두더지 분획 또는 가스 혼합물 성분의 두더지를 해결할 수 있습니다.
p i =p t (n i / n t )
여기, p i 개별 가스의 부분 압력, p t 입니다 혼합물의 총 압력, n i 입니다 가스의 두더지 수이고 n t 혼합물의 모든 가스의 총 두더지 수입니다.
두더지 분율, 성분의 압력 또는 총 압력, 성분의 부피 또는 총 부피의 부피, 성분의 두더지 수와 가스의 총 두더지를 해결할 수 있습니다.
x i =p i / p t =v i / v t =n i / n t
여기, x i 가스 혼합물의 성분 (i)의 두더지 분율, P는 압력, V는 부피이며 N은 몰수입니다.
Dalton의 부분 압력 법칙에 대한 가정
Dalton의 법칙은 가스가 이상적인 가스로 행동한다고 가정합니다.
- 가스의 부분 압력은 가스 혼합물에서 개별 성분에 의해 가해지는 압력입니다.
- 가스 분자는 가스의 동역학 이론을 따릅니다. 다시 말해서, 그들은 서로 널리 분리되어 있고 서로에 의해 끌리거나 서로에 의해 끌리지 않으며, 서로와 컨테이너 벽과 탄력있는 충돌을받는 지점의 질량으로 행동합니다. .
Dalton의 법칙은 가스 행동을 상당히 예측하지만 압력이 증가함에 따라 실제 가스는 법에서 벗어납니다. 고압에서는 가스 분자 사이에 공간이 적고 그들 사이의 상호 작용이 더욱 중요해집니다.
Dalton의 법률 사례 및 작업 문제
다음은 Dalton의 부분 압력 법칙을 어떻게 사용하는지 보여주는 예입니다.
Dalton의 법칙을 사용하여 부분 압력 계산
예를 들어, 질소, 이산화탄소 및 산소의 혼합물에서 산소 가스의 부분 압력을 계산하십시오. 혼합물은 총 압력이 150kPa이며 질소 및 이산화탄소의 부분 압력은 각각 100 kPa 및 24kPa입니다.
이것은 Dalton의 법칙을 간단하게 적용 한 것입니다.
p t =p 1 + p 2 + p 3
p 총 =p 질소 + p 이산화탄소 + p 산소
150 kPa =100 kPa + 24 kPa + p 산소
p 산소 =150 kPa - 100 kPa - 24kpa
p 산소 =26 kPa
항상 작업을 확인하십시오. 부분 압력을 추가하고 올바른 총계를 얻으십시오.
Dalton의 법칙을 사용하여 두더지 분율 계산
예를 들어, 수소와 산소 가스의 혼합물에서 산소의 두더지 분율을 찾으십시오. 혼합물의 총 압력은 1.5 atm이고 수소의 부분 압력은 1 atm입니다.
Dalton의 법칙으로 시작하여 산소 가스의 부분 압력을 찾으십시오.
p t =p 1 + p 2
p 총 =p 수소 + p 산소
1.5 atm =1 atm + p 산소
p 산소 =1.5 ATM - 1 ATM
p 산소 =0.5 atm
다음으로, 두더지 분율에 대한 공식을 적용하십시오.
x i =p i / p t
x
x
두더지 분획은 순수한 숫자입니다. 분자의 분자 및 분모 모두에서 동일하다면 어떤 압력 장치를 사용하는지는 중요하지 않습니다.