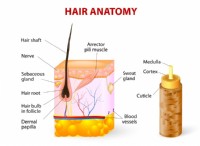
1. 색상과 냄새
* 별개의 색상 : 많은 할로겐은 기체 상태에서 특징적인 색상을 가지고 있습니다.
* 불소 (F2) : 옅은 황록색
* 염소 (Cl2) : 황록색
* Bromine (BR2) : 적갈색 (실온에서 액체이지만 증기는 적갈색입니다)
* 요오드 (i2) : 바이올렛 (실온에서는 고체이지만 증기는 바이올렛입니다)
* 매운 악취 : 할로겐은 일반적으로 강하고 자극적 인 냄새가납니다.
2. 반응성
* 높은 반응성 : 할로겐은 매우 반응성 비금속입니다. 그들은 다른 많은 요소들과 화합물을 쉽게 형성합니다.
* 금속과의 반응 : 할로겐은 금속과 반응하여 염 (이온 성 화합물)을 형성합니다. 예를 들어, 염소 가스는 나트륨과 반응하여 염화나트륨을 형성합니다 (표).
* 수소와의 반응 : 할로겐은 수소와 반응하여 수소 할로이드를 형성한다 (예를 들어, HCl, HBR).
* 표백 속성 : 염소와 같은 일부 할로겐에는 표백 특성이 있습니다.
3. 화학적 특성
* 높은 전기 음성 : 할로겐은 전기 음성이 매우 높기 때문에 화학 결합에서 전자를 유치하는 경향이 있습니다.
* 산화 상태 : 할로겐은 일반적으로 다른 원소와 결합 될 때 -1 산화 상태에 존재합니다.
4. 주기율표의 위치
* 그룹 17 : 할로겐은 주기율표의 그룹 17 (VIIA)에서 발견됩니다. 그들은 고귀한 가스의 오른쪽에 직접 위치합니다.
중요한 참고 :
* 독성이 있고 부식성이있을 수 있으므로 할로겐을주의해서 다루는 것이 중요합니다. 적절한 교육 및 안전 장비 없이는 실험하지 마십시오.
더 이상 질문이 있으면 알려주세요!