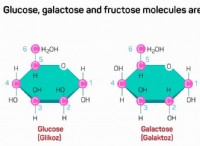
운동 분자 이론의 유용성을 제한 할 수있는 두 가지 조건은 다음과 같습니다.
1. 고압 : 이 이론은 용기 부피에 비해 무시할만한 양의 가스 분자를 가정합니다. 고압에서 분자는 더 가깝게 포장되고 부피는 더 중요한 요소가되어 이상적인 가스 거동과의 편차가 발생합니다.
2. 저온 : 이론은 가스 분자가 무시할만한 분자간 힘을 가지고 있다고 가정합니다. 저온에서 분자는 느리게 움직이고 분자간 힘이 더 중요해집니다. 이 힘은 응축과 같은 이상적인 가스 거동으로 인한 편차를 유발할 수 있습니다.
중요한 참고 : 이러한 조건은 이론의 정확성을 제한하지만, 여전히 많은 상황에서 가스의 행동을 이해하고 예측하는 강력한 도구입니다. 그것은 거시적 특성 (압력, 부피, 온도)과 미세한 특성 (분자 운동, 분자간 힘) 사이의 관계를 이해하기위한 기본 프레임 워크를 제공합니다.