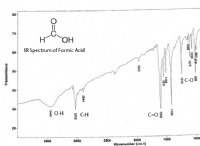
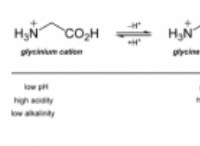
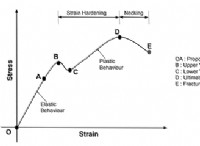
동역학의 과학적 정의
동역학 화학 반응의 속도와 메커니즘을 연구하는 물리 화학의 지점입니다. 그것은 다음에 중점을 둡니다.
* 반응 속도 : 시간이 지남에 따라 반응물 또는 생성물의 농도 변화에 의해 측정 된 반응이 얼마나 빨리 진행되는지.
* 반응 메커니즘 : 중간체 및 전이 상태의 형성을 포함하여 반응이 발생하는 단계별 프로세스.
* 반응 속도에 영향을 미치는 요인 : 반응이 얼마나 빨리 진행되는지에 영향을 미치는 온도, 농도, 촉매, 표면적 및 기타 변수.
본질적으로, 동역학은 화학 변화의 역학을 조사하여 반응이 얼마나 빠르고 반응이 발생하는지에 중점을 둡니다.
동역학 내의 몇 가지 주요 개념은 다음과 같습니다.
* 법률 : 반응 속도와 반응물 농도 사이의 관계를 설명하는 수학적 방정식.
* 활성화 에너지 : 반응이 발생하는 데 필요한 최소 에너지 양.
* 촉매 : 과정에서 소비하지 않고 반응 속도를 높이는 물질.
* 평형 : 순방향 및 역 반응의 속도가 동일 한 상태.
동역학에는 다음을 포함하여 다양한 분야에 응용 프로그램이 있습니다
* 화학 공학 : 화학 공정 설계 및 최적화.
* 재료 과학 : 재료 특성을 이해하고 제어합니다.
* 생화학 : 효소 활성 및 대사 경로 연구.
* 환경 과학 : 환경의 화학 반응 분석.
동역학을 이해함으로써 우리는 화학 반응의 행동을 예측하고 조작하여 다양한 분야의 발전을 초래할 수 있습니다.