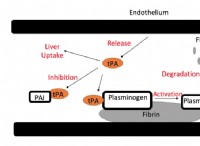
반응 :
2 li (s) + 2 H₂O (l) → 2 lioh (aq) + H₂ (g)
엔탈피 변화 (ΔH) 계산 :
반응과 관련된 각 화합물에 대한 표준 형성 엔탈피 (ΔHF °)를 찾아야합니다. 이 값은 일반적으로 화학 교과서 또는 온라인 데이터베이스에서 찾을 수 있습니다.
다음은 가상의 ΔHF ° 값을 사용한 단순화 된 예입니다 (실제 값을 찾아야합니다).
* ΔHF ° [lioh (aq)] =-485 kj/mol
* ΔHF ° [H₂ (g)] =0 kj/mol (정의에 따라)
* ΔHF ° [li (s)] =0 kj/mol (정의 별)
* ΔHF ° [HATER (l)] =-286 kJ/mol
Hess의 법칙 사용 :
ΔH =[σ ΔHF ° (제품)] - [σ ΔHF ° (반응물)]
ΔH =[2 * (-485 kj/mol) + 0]-[2 * 0 + 2 * (-286 kj/mol)]
ΔH =-970 kJ/mol + 572 kJ/mol
ΔH =-398 kJ/mol
중요한 참고 : 이 결과는 * 두 * 몰의 리튬의 반응을위한 것입니다. 리튬의 두더지 당 에너지를 얻으려면 2로 나눕니다.
-398 kj/mol/2 = -199 kj/mol
따라서 리튬과의 반응은 리튬 몰당 약 199 kJ의 에너지를 방출합니다.
안전 :
이 반응은 매우 활발하고 가연성 가스를 생성한다는 것을 기억하십시오. 항상 조심스럽게 리튬과 물을 처리하고 적절한 안전 장비와 감독 없이는이 실험을 수행하지 마십시오.