주요 차이 - 전자 형상 대 분자 형상
분자의 형상은 해당 분자의 반응성, 극성 및 생물학적 활성을 결정합니다. 분자의 형상은 전자 형상 또는 분자 형상으로 주어질 수 있습니다. VSEPR 이론 (원자가 쉘 전자 쌍 반발 이론)은 분자의 형상을 결정하는 데 사용될 수 있습니다. 전자 형상은 분자에 존재하는 고독한 전자 쌍을 포함한다. 분자 형상은 특정 분자가 보유한 결합의 수에 의해 결정될 수있다. 전자 형상과 분자 형상의 주요 차이점은 분자에서 고독한 전자 쌍과 결합을 모두 가져 와서 전자 형상이 발견되는 반면, 분자에 존재하는 결합 만 사용하여 분자 기하학이 발견된다는 것입니다. . .
주요 영역을 다루었습니다
1. 전자 형상
- 정의, 식별, 예
2. 분자 형상
- 정의, 식별, 예
3. 분자의 기하학은 무엇입니까
- 설명 차트
4. 전자 형상과 분자 형상의 차이점
- 주요 차이점 비교
주요 용어 :전자 형상, 고독한 전자 쌍, 분자 형상, VSEPR 이론 
전자 형상이란?
전자 형상은 결합 전자 쌍과 고독한 전자 쌍을 모두 고려하여 예측 된 분자의 모양입니다. VSEPR 이론은 특정 원자 주위에 위치한 전자 쌍이 서로를 격퇴한다고 밝혔다. 이 전자 쌍은 결합 전자 또는 비 결합 전자 일 수 있습니다.
전자 형상은 분자의 모든 결합과 고독한 쌍의 공간 배열을 제공합니다. 전자 형상은 VSEPR 이론을 사용하여 얻을 수 있습니다.
전자 형상을 결정하는 방법
다음은이 결정에 사용 된 단계입니다.
- 분자의 중심 원자를 예측합니다. 가장 전기 음성 원자가되어야합니다.
- 중앙 원자에서 원자가 전자의 수를 결정합니다.
- 다른 원자에 의해 기증 된 전자의 수를 결정하십시오.
- 중앙 원자 주위의 총 수 전자를 계산합니다.
- 그 숫자를 2로 나눕니다. 이것은 존재하는 전자 그룹의 수를 제공합니다.
- 위에서 얻은 입체 수에서 중앙 원자 주위에 존재하는 단일 결합의 수를 공제합니다. 이것은 분자에 존재하는 고독한 전자 쌍의 수를 제공합니다.
- 전자 형상을 결정하십시오.
예
ch 4 의 전자 형상
분자의 중심 원자 =C
C =4
의 원자가 전자 수
수소 원자에 의해 기증 된 전자 수 =4 x (h)
=4 x 1 =4
C =4 + 4 =8
주위의 총 전자 수전자 그룹의 수 =8 / 2 =4
단일 채권의 수 =4
고독한 전자 쌍의 수 =4 - 4 =0
따라서 전자 형상 = 사면체

그림 1 :ch 4 의 전자 형상
암모니아의 전자 형상 (NH3)
분자의 중심 원자 =n
n =5
의 원자가 전자 수
수소 원자에 의해 기증 된 전자 수 =3 x (h)
=3 x 1 =3
n =5 + 3 =8
주위의 총 전자 수전자 그룹의 수 =8 / 2 =4
단일 채권의 수 =3
고독한 전자 쌍의 수 =4 - 3 =1
따라서 전자 형상 = 사면체

그림 2 :암모니아의 전자 형상
Alcl3의 전자 형상
분자의 중심 원자 =al
al =3
의 원자가 전자의 수
Cl 원자에 의해 기증 된 전자 수 =3 x (cl)
=3 x 1 =3
n =3 + 3 =6
주위의 총 전자 수전자 그룹의 수 =6 / 2 =3
단일 채권의 수 =3
고독한 전자 쌍의 수 =3 - 3 =0
따라서 전자 형상 = 삼각 평면
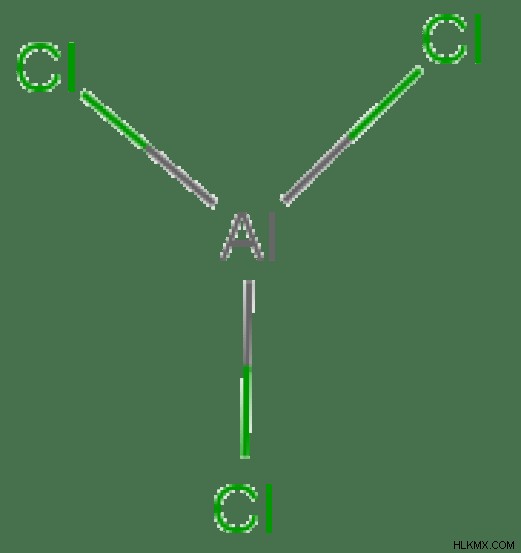
그림 3 :ALCL3의 전자 형상
때로는 전자 형상과 분자 형상이 동일합니다. 이는 고독한 전자 쌍이없는 상태에서 형상 결정에서 결합 전자 만 고려되기 때문입니다.
분자 형상
분자 형상은 결합 전자 쌍 만 고려하여 예측 된 분자의 모양입니다. 이 경우, 고독한 전자 쌍은 고려되지 않습니다. 또한, 이중 결합 및 삼중 채권은 단일 결합으로 간주된다. 형상은 고독한 전자 쌍이 결합 전자 쌍보다 더 많은 공간이 필요하다는 사실에 기초하여 결정됩니다. 예를 들어, 특정 분자가 고독한 쌍과 함께 2 쌍의 결합 전자로 구성되는 경우, 분자 기하학은 선형이 아니다. 고독한 전자 쌍은 2 개의 결합 전자 쌍보다 더 많은 공간이 필요하기 때문에“구부러짐 또는 각도”가 있습니다.
분자 형상의 예
H 2 의 분자 기하학 o
분자의 중앙 원자 =o
O =6
의 원자가 전자 수
수소 원자에 의해 기증 된 전자 수 =2 x (h)
=2 x 1 =2
n =6 + 2 =8
주위의 총 전자 수전자 그룹의 수 =8 / 2 =4
고독한 전자 쌍의 수 =2
단일 채권의 수 =4 - 2 =2
따라서 전자 형상 =구부러진
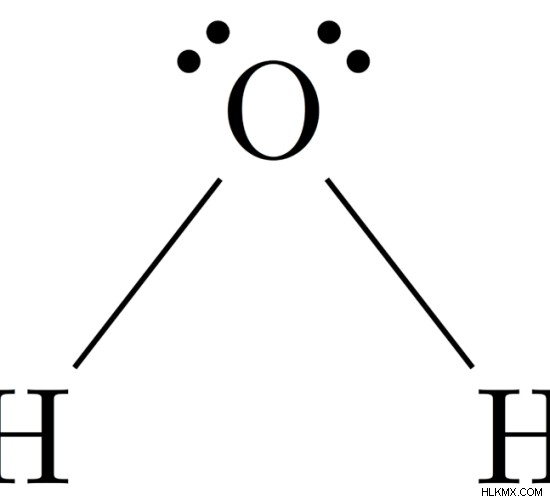
그림 4 :H2O의 분자 기하학
암모니아의 분자 기하학 (NH <서브> 3 )
분자의 중심 원자 =n
n =5
의 원자가 전자 수
수소 원자에 의해 기증 된 전자 수 =3 x (h)
=3 x 1 =3
n =5 + 3 =8
주위의 총 전자 수전자 그룹의 수 =8 / 2 =4
고독한 전자 쌍의 수 =1
단일 채권의 수 =4 - 1 =3
따라서 전자 형상 = 삼각 피라미드
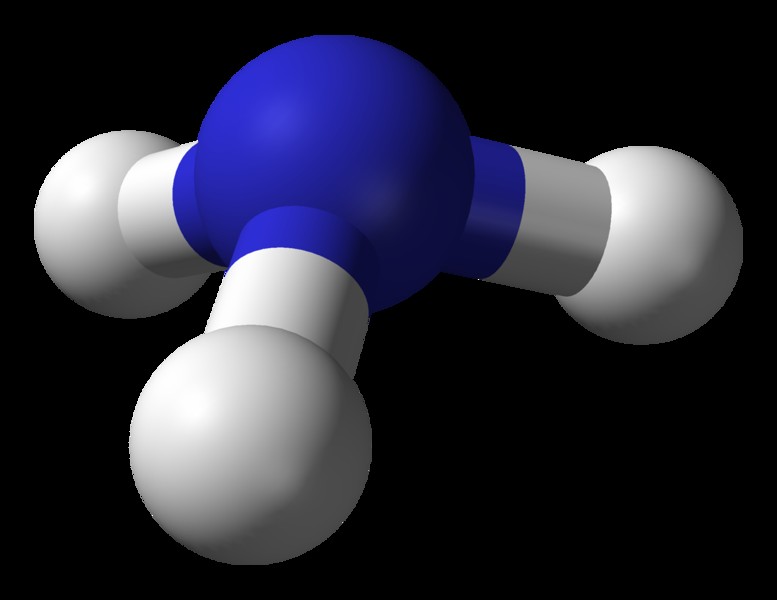
그림 5 :암모니아 분자의 볼과 스틱 구조
암모니아의 전자 형상은 사면체입니다. 그러나 암모니아의 분자 기하학은 삼각 피라미드입니다.
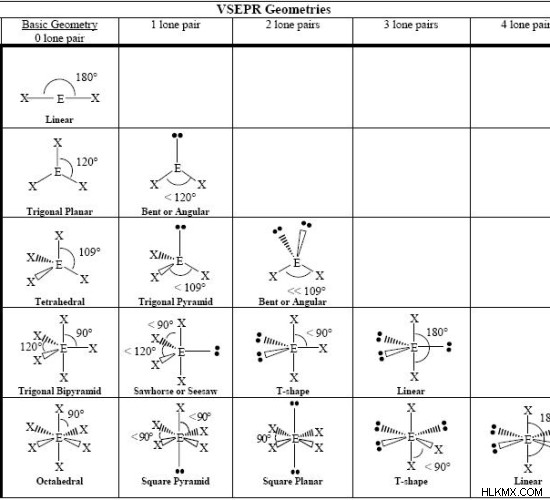
분자의 기하학
다음 차트는 존재하는 전자 쌍의 수에 따른 일부 분자의 형상을 보여줍니다.
| 전자 쌍의 수 | 본딩 전자 쌍의 수 | 고독한 전자 쌍의 수 | 전자 형상 | 분자 형상 |
| 2 | 2 | 0 | 선형 | 선형 |
| 3 | 3 | 0 | 삼각 평면 | 삼각 평면 |
| 3 | 2 | 1 | 삼각 평면 | 구부러진 |
| 4 | 4 | 0 | 사면체 | 사면체 |
| 4 | 3 | 1 | 사면체 | 삼각 피라미드 |
| 4 | 2 | 2 | 사면체 | 구부러진 |
| 5 | 5 | 0 | 삼중 피라미드 | 삼중 피라미드 |
| 5 | 4 | 1 | 삼중 피라미드 | 시소 |
| 5 | 3 | 2 | 삼중 피라미드 | T 자형 |
| 5 | 2 | 3 | 삼중 피라미드 | 선형 |
| 6 | 6 | 0 | 팔면체 | 팔면체 |