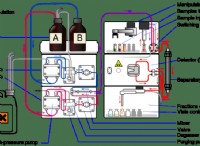
산 :
* 양성자 (H+) : 산은 물에 용해 될 때 양성자로도 알려진 수소 이온 (H+)을 방출하는 물질이다.
* H+ 농도 증가 : 용액에 더 많은 양성자의 존재는 용액을보다 산성으로 만듭니다.
베이스 :
* 수용자 (H+) : 염기는 물에 용해 될 때 양성자 (H+)를 수용하는 물질입니다.
* H+ 농도 감소 : 염기는 용액으로부터 양성자를 제거하여 용액을 덜 산성 (보다 기본)으로 만듭니다.
산과 염기 혼합 :
* 중화 반응 : 산과 염기가 반응하면 중화 반응을 겪습니다. 이것은 산의 양성자 (H+)가 염기의 수산화물 이온 (OH-)과 반응하여 물 (H2O)을 형성하는 과정입니다.
* 예 : HCl (산) + NaOH (베이스) -> NaCl (Salt) + H2O (물)
* pH 변화 : 염기에 산을 첨가 (또는 그 반대) 용액의 pH의 변화를 초래합니다.
* 산 + 염기 -> 더 중성 pH :산과 염기가 동일한 양이면 서로 중화되어 pH가 7에 가까운 중성 용액을 초래합니다.
* 과잉 산 -> 하부 pH : 산이 과도한 경우 용액은 pH가 낮은 산성으로 유지됩니다.
* 초과베이스 -> 높은 pH : 기본이 과도한 경우 용액이 더 높은 pH로 더 기본화됩니다.
키 포인트 :
* 양성자는 산-염기 반응의 핵심 플레이어입니다.
* 산은 양성자를 기증하고, 염기는 그들을 받아들입니다.
* 중화화는 양성자와 수산화물 이온이 결합되어 물을 형성하는 과정입니다.
* 용액의 pH는 양성자의 농도를 반영합니다.
더 자세한 설명이나 특정 산-염기 반응의 예를 원하시면 알려주십시오!