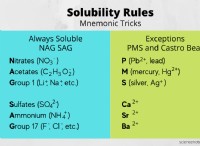
1. 균형 화학 방정식을 작성하십시오 :
srcl₂ (aq) + h₂so₄ (aq) → srso₄ (s) + 2 HCl (aq)
2. 각 반응물의 몰 질량을 계산하십시오 :
* SRCL 8 :87.62 g/mol (SR) + 2 * 35.45 g/mol (CL) =158.52 g/mol
* h *so 2 :2 * 1.01 g/mol (H) + 32.07 g/mol (S) + 4 * 16.00 g/mol (O) =98.08 g/mol
3. 황산의 질량을 두더지로 변환하십시오 :
* H₂SOAT의 두더지 =(300 g) / (98.08 g / mol) =3.06 mol
4. 균형 방정식의 화학량 론을 사용하여 클로라이드 스트론튬의 두더지를 찾으십시오.
* 방정식은 srcl₂과 h₂so₄ 사이의 1 :1 몰비를 보여줍니다. 따라서, 3.06 mol의 h ₂소는 3.06 mol의 srcl₂와 반응 할 것이다.
5. 클로라이드 스트론튬 무더미트를 그램으로 변환합니다.
* srclr의 질량 =(3.06 mol) * (158.52 g/mol) =486.25 g
따라서 따라서 약 486.25 그램의 염화물은 300 그램의 황산과 반응 할 것입니다. .