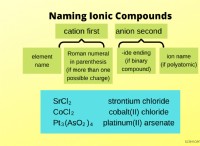
이중 변위 반응 :
* 정의 : 2 개의 반응물이 이온을 교환하는 반응, 2 개의 새로운 화합물의 형성을 초래한다.
* 일반 양식 : AB + CD → AD + CB
* 예 :
* NaCl (aq) + agno₃ (aq) → agcl (s) + nano₃ (aq) (침전 반응)
* NAOH (AQ) + HCL (AQ) → NACL (AQ) + HATER (L) (중화 반응)
* 산-염기에만 국한되지 않음 : 강수, 가스 형성 또는 관찰 가능한 변화가 포함될 수 있습니다.
산-염기 반응 :
* 정의 : 산에서 염기로 양성자 (H⁺)의 전달을 포함하는 특수 유형의 이중 변위 반응.
* 일반 양식 : HA + BOH → BA + HATER
* ha =산 (양성자 공여자)
* BOH =베이스 (양성자 수용자)
* 예 :
* HCL (AQ) + NAOH (AQ) → NACL (AQ) + HATER (L)
* hqso a (aq) + ca (OH) ₂ (aq) → caso₄ (aq) + 2h₂o (l)
* 은 항상 물의 형성을 포함합니다 : 산으로부터의 hines는 기저부에서 물 (HATE)을 형성하는 OH태와 결합된다.
* 은 더 분류 될 수 있습니다 : 관련된 산 및 염기의 강도에 기초하여 강한/약산-염기 반응으로.
다음은 주요 차이점을 요약 한 표입니다.
| 기능 | 이중 변위 반응 | 산-염기 반응 |
| --- | --- | --- |
| 정의 | 두 반응물 사이의 이온 교환 | 산에서 염기로의 양성자 (H ()의 이동 |
| 일반 양식 | AB + CD → AD + CB | HA + BOH → BA + HATER |
| 물 형성 | 반드시 | 항상 물을 형성합니다 |
| 예 | 강수, 가스 형성, 중화 | 중화, 산베이스 적정 |
| 특이성 | 광범위한 카테고리 | 특정 유형의 이중 변위 |
본질적으로, 산-염기 반응은 이중 변위 반응의 특별한 경우 입니다. 이온의 특정 교환에는 양성자가 포함되며 물의 형성은 항상 정의 된 특징입니다.