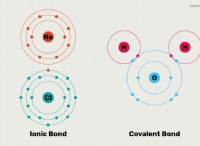
1. 초기 상태 :
* 혼합 전 : 각 액체의 분자는 분자간 힘 (수소 결합, 쌍극자 쌍극자 상호 작용 또는 런던 분산 힘)으로 인해 함께 클러스터링됩니다. 그것들은 각자의 단계 내에서 일정한 무작위 운동에 있습니다.
2. 혼합 과정 :
* 확산 : 액체가 접촉되면 계면의 분자가 혼합되기 시작합니다. 이것은 분자가 확산되고 이용 가능한 공간을 차지하는 자연적인 경향 때문에 발생합니다. 각 액체의 분자는 다른 액체로 확산됩니다.
* 충돌 : 분자는 끊임없이 서로 충돌합니다. 이러한 충돌은 에너지를 전달하여 일부 분자가 에너지를 얻고 더 빨리 움직이고 다른 분자는 에너지를 잃고 느리게 움직입니다.
* 혼합 : 두 액체의 분자는 결국 혼합물 전체에 고르게 분포됩니다. 이것은 분자의 무작위 운동과 모든 방향으로 움직이는 일정한 충돌로 인해 발생합니다.
3. 평형 :
* 균일 분포 : 액체가 완전히 혼합되면, 분자는 혼합물 전체에 균일하게 분포된다. 더 이상 한 액체 또는 다른 액체의 뚜렷한 영역이 없습니다.
* 동적 평형 : 분자는 균등하게 분포되어 있지만 계속 움직이고 충돌합니다. 이 동적 평형은 혼합물이 시간이 지남에 따라 균질하게 유지되도록합니다.
혼합에 영향을 미치는 요인 :
* 온도 : 온도가 높을수록 분자 운동이 빠르고 혼합이 더 빠릅니다.
* 점도 : 점도가 낮은 액체는 분자가 더 자유롭게 움직일 수 있기 때문에 더 쉽게 혼합됩니다.
* 용해도 : 액체 혼합 정도는 용해도에 따라 다릅니다. 일부 액체는 혼잡하고 (서로 완전히 용해되지 않음), 다른 액체는 불가능합니다 (혼합하지 않음).
중요한 참고 : 액체에서 분자의 움직임은 매우 빠르고 무작위입니다. 혼합의 거시적 효과 (예를 들어, 균질 한 용액의 형성)를 관찰 할 수는 있지만 개별 분자가 움직이고 충돌하는 것을 직접 볼 수는 없습니다.