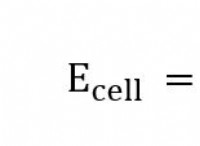대조적 인 나트륨 및 염화물 이온
다음은 나트륨과 클로라이드 이온의 차이점이 형성을 포함하여 다음과 같습니다.
나트륨 이온 (Na+)
* 형성 : 나트륨 (NA)은 가장 바깥 쪽 쉘에 하나의 전자가있는 금속입니다. 안정적인 옥켓 구성을 달성하기 위해이 전자를 쉽게 잃어 버리고 양으로 하전 된 이온 (양이온)이됩니다. 이 과정을 이온화라고합니다.
* 기호 : Na+
* 속성 :
* 작은 크기
* 높은 전하 밀도
* 고도로 반응성은 이온 성 결합을 쉽게 형성합니다
클로라이드 이온 (Cl-)
* 형성 : 염소 (CL)는 가장 바깥 쪽 쉘에 7 개의 전자가있는 비금속입니다. 안정적인 옥켓 구성을 달성하기 위해 하나의 전자를 얻고 음이온 (음이온)이됩니다.
* 기호 : 클의 뜻
* 속성 :
* 나트륨 이온보다 큰 크기
* 충전 밀도가 낮습니다
* 나트륨 이온에 비해 덜 반응성
주요 차이점 :
* 충전 : 나트륨 이온은 양으로 하전되어 (Na+), 클로라이드 이온은 음으로 하전됩니다 (Cl-).
* 형성 : 나트륨은 전자를 잃고 양이온을 형성하는 반면 염소는 전자를 얻기 위해 전자를 얻습니다.
* 크기 : 나트륨 이온은 클로라이드 이온보다 작습니다.
* 반응성 : 나트륨 이온은 클로라이드 이온보다 반응성이 높습니다.
형성 방법 :
나트륨 및 염소 원자는 이온 결합을 형성합니다. 이 결합은 반대로 하전 된 이온 사이의 정전기 인력으로 인해 형성된다. 나트륨 원자 (NA)가 염소 원자 (CL)와 상호 작용할 때, 나트륨 원자는 염소 원자에 가장 바깥 쪽 전자를 잃게된다. 나트륨 원자는 양으로 하전 된 나트륨 이온 (Na+)이되고, 염소 원자는 음으로 하전 된 염화물 이온 (Cl-)이된다. 이 반대로 하전 된 이온은 서로를 끌어 들여 이온 성 화합물 염화나트륨 (NaCl) 또는 테이블 소금을 형성합니다.
요약 :
나트륨 및 염화물 이온은 많은 생물학적 과정에서 필수 성분이며 다른 형성 과정 및 전하로 인해 별개의 특성을 갖습니다. 그들의 상호 작용은 클로라이드 나트륨과 같은 이온 성 화합물의 형성으로 이어지며, 이는 우리 삶에서 중요한 역할을합니다.