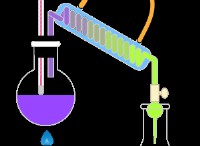
반응 :
* fecl> (철 (II) 클로라이드)은 fe³⁺ 로 산화된다 (철 (III) 이온).
* kmno₄ (칼륨 과망간산염)는 mn² 로 감소된다 (망간 (II) 이온).
균형 화학 방정식은 다음과 같습니다.
5fe²⁺ + mno₄⁻ + 8h⁺ → 5fe³⁺ + mn²⁺ + 4h₂o
설명 :
* fe² fe 전자를 잃고 fe³⁺ 로 산화되는 환원제입니다. .
* mno> 산화제는 전자를 얻고 mn² 로 감소됩니다. .
* h₂so> 반응이 진행되는데 필요한 산성 배지를 제공한다. 또한 적정의 종말점을 가릴 수있는 이산화 망염 (mno₂)의 형성을 방지하는 데 도움이됩니다.
무엇이 형성됩니까?
적정 중에 다음이 형성됩니다.
* fe³ fe 용액에서 (철 (III) 이온).
* mn²> 용액에서 (망간 (II) 이온).
* 물 (h>o) 반응의 산물로서.
종말점 :
적정의 종말점은 해당 이온의 희미한 핑크색이 용액에서 지속될 때 도달하여 모든 Fe² 이온이 산화되었음을 나타냅니다.
중요한 메모 :
* 반응은 강력한 산성 용액에서 수행되어 과망간산염 이온이 Mn²으로 완전히 감소되도록합니다.
* 완전한 반응과 날카로운 종말점을 위해 적정을 천천히 조심스럽게 수행해야합니다.
요약하면, h₂so₄의 존재하에 Kmno₄와의 fecl₂의 적정은 Fe³⁺, mn²⁺ 및 물의 형성을 초래한다. 이 과정은 철 (II) 이온의 농도를 결정하는 데 사용되는 고전적인 산화 환원 반응입니다.