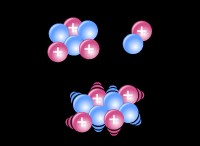
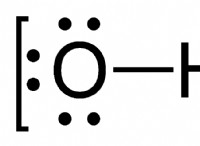강산 :
* 용액에서 완전히 이온화 : 물에 용해 될 때, 강산은 모든 수소 이온 (H+)을 용액에 기증합니다. 이것은 용액에 피해진 산산 분자가 없음을 의미합니다.
* 높은 해리 상수 (ka) : KA는 산의 강도의 척도입니다. 강산은 KA 값이 매우 큰 KA 값을 가지며, 이는 양성자를 기증하는 경향이 높다.
* 예 : 염산 (HCL), 질산 (HNO3), 황산 (H2SO4), 과염산 (HCLO4)
약산 :
* 용액에서 부분적으로 이온화 : 물에 용해 될 때, 약산은 수소 이온의 작은 부분 만 기부합니다. 이는 산의 상당 부분이 용액에서 해제되지 않은 상태로 남아 있으며, 이온이 아닌 분자로 존재한다는 것을 의미한다.
* 낮은 해리 상수 (ka) : 약산은 작은 ka 값을 가지며, 이는 양성자를 기증하는 경향이 제한적임을 나타낸다.
* 예 : 아세트산 (CH3COOH), 탄산산 (H2CO3), 포름산 (HCOOH), 구연산 (C6H8O7)
다음은 더 잘 이해하는 비유입니다.
과일 바구니 2 개, 하나는 잘 익은 바나나와 하나는 익은 바나나가 있다고 상상해보십시오.
* 강산 : 첫 번째 바구니의 잘 익은 바나나는 강산의 이온과 같습니다. 그들은 쉽게 구할 수 있으며 H+ 이온을 "선택"(기부)하기 쉽습니다.
* 약산 : 두 번째 바구니의 미숙 한 바나나는 약산의 분자와 같습니다. 그들은 그들의 H+ 이온을 "선택"(기부)하기가 더 어렵다.
키 테이크 아웃 :
* 강산은 완전히 이온화되며 약산은 부분적으로 이온화됩니다.
* 이온화 정도는 산의 강도를 결정합니다.
* 강산은 Ka가 높고 약산은 Ka가 낮습니다.
중요한 참고 : "강한"및 "약한"이라는 용어는 농도가 아니라 이온화 정도를 나타냅니다. 농축 된 약산은 여전히 상당히 산성 일 수 있습니다.