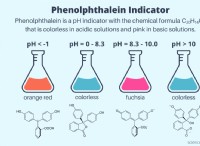
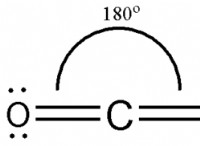
작동 방식은 다음과 같습니다.
* 산 : 물은 다른 분자에 양성자 (H+)를 기증하여 수산화물 이온 (OH-)을 남겨 둘 수 있습니다.
예 : 암모니아 (NH3)와의 반응에서, 물은 양성자를 기증하여 히드로 늄 이온 (H3O+) 및 수산화 이온 (OH-)을 형성한다 :
H2O + NH3 ⇌ NH4 + + OH-
* 베이스 : 물은 다른 분자로부터 양성자 (H+)를 수용하여 히드로 늄 이온 (H3O+)을 형성 할 수있다.
예 : 염산 (HCL)과의 반응에서, 물은 HCl로부터 양성자를 받아 들여, 히드로 늄 이온 (H3O+) 및 클로라이드 이온 (Cl-)을 형성한다 :
H2O + HCl + H3O + + Cl-
물의 자동 이온화 :
물 이온화로 알려진 과정에서 물은 심지어 그 자체로 반응 할 수 있습니다.
2H2O ⇌ H3O + + OH-
이 반응은 평형 상태이며, 주어진 시간에 매우 적은 양의 H3O+ 및 OHION이 존재합니다. 이 평형은 pH 척도를 정의하고 산-염기 반응을 이해하는 데 필수적입니다.
요약 :
물의 산과베이스로 작용하는 능력은 화학 반응에서의 역할과 다양한 용액에서의 행동을 이해하는 데 중요합니다. 이 특성은 다양한 화학 공정에서 다재다능한 용매와 핵심 구성 요소로 만듭니다.