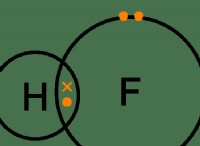
이유는 다음과 같습니다.
* 원자가 전자 : These are the electrons in the outermost shell of an atom, and they are the ones involved in chemical bonding.
* 옥트 규칙 : Most atoms strive to have eight electrons in their valence shell to achieve a stable electron configuration similar to that of noble gases. 이것은 옥트 규칙이라고합니다.
* 고귀한 가스 : These elements are located in Group 18 (VIIIa) of the periodic table. They have a full outer shell of electrons, making them very unreactive.
Examples of noble gases:
* Helium (He) - 2 valence electrons
* Neon (Ne) - 8 valence electrons
* Argon (Ar) - 8 valence electrons
* Krypton (Kr) - 8 valence electrons
* Xenon (Xe) - 8 valence electrons
* Radon (Rn) - 8 valence electrons
중요한 참고 : 옥트 규칙은 유용한 지침이지만, 특히 두 번째 기간 (베릴륨 및 붕소)의 요소와 더 무거운 요소에 대한 예외가 있습니다.