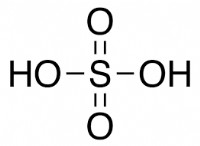
용어 이해
* Molarity (m) : 용액의 용액 당 두더지로 표현 된 용액의 농도를 나타냅니다.
* molality (m) : 용매 킬로그램 당 용질의 두부로 표현 된 용액의 농도를 나타냅니다.
계산
1. 몰 리티티를 몰로 변환 : 우리는 용액의 부피가 주어지기 때문에, 몰 리탈 (m)를 몰로 (m)로 변환해야합니다. 이를 위해서는 솔루션의 밀도를 알아야합니다.
용액의 밀도가 없으면 몰도에서 몰토리로 정확하게 변환 할 수 없습니다. 우리는 용액이 희석되었다고 가정 할 때만 어금니를 근사화 할 수 있습니다 (밀도가 물의 밀도에 매우 가깝다는 것을 의미합니다. 1 kg/l).
2. 계산 두더지 :
* 희석 용액을 가정합니다 (밀도 ≈ 1 kg/l) :
* Molarity (m) ≈ molality (m) =2.00 m
* Moles =Molarity (m) x 볼륨 (L)
* Moles =2.00 m x 1.75 l = 3.50 Moles of Na2Cro4
중요한 참고 : 이 계산은 근사치입니다. 보다 정확한 답변을 얻으려면 몰도를 몰로 변환하려면 용액의 밀도가 필요합니다.