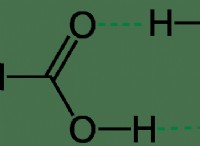
포름 산의 이온화
포름산 (HCOOH)은 약산으로 물에서 부분적으로 이온화됩니다. 이것은 그것이 이온에 완전히 분리되지 않는다는 것을 의미합니다. 이온화 과정의 작동 방식은 다음과 같습니다.
1. 평형 :
포름산 (HCOOH)은 물 (HATER)과 반응하여 포르 메이트 이온 (HCOO⁻) 및 히드로 늄 이온 (HATERON)을 형성합니다. 이 반응은 평형이며, 이는 양방향으로 진행됩니다.
```
hcooh (aq) + h₂o (l) ⇌ hcoo⁻ (aq) + h₃o⁺ (aq)
```
2. 이온화 상수 (KA) :
포름 산 이온화 정도는 산성 이온화 상수 (KA)로 표현됩니다. KA는 산의 강도를 측정 한 것입니다. KA 값이 클수록 산이 강해집니다.
포름산의 경우 KA 값은 대략 1.8 x 10 입니다. .
3. 핵심 사항 :
* 부분 이온화 : 작은 비율의 포름산 분자만이 실제로 물에서 이온화됩니다.
* 평형 : 이온화 반응은 평형이며, 이는 순방향 및 역 반응이 동시에 발생한다는 것을 의미한다.
* 약산 : 포름산은 KA 값이 낮기 때문에 약산으로 간주됩니다.
4. 이온화에 영향을 미치는 요인 :
몇 가지 요인이 다음을 포함하여 포름산의 이온화에 영향을 줄 수 있습니다.
* 농도 : 더 높은 농도의 포름산은 더 높은 농도의 이온을 초래할 것이다.
* 온도 : 온도를 증가 시키면 일반적으로 전진 반응이 선호되고 이온화가 증가합니다.
* 다른 산 또는 염기의 존재 : 다른 산 또는 염기의 존재는 평형을 이동시키고 포름산의 이온화에 영향을 줄 수 있습니다.
5. 중요성 :
포름산의 이온화는 산도와 그것이 다른 화학 물질과 어떻게 반응하는지 이해하는 데 중요합니다. 또한 다양한 생물학적 및 산업 과정에서 역할을합니다.
요약 :
포름산은 물에서 부분적으로 이온화되는 약산입니다. 이온화는 산성 이온화 상수 (KA)를 특징으로하는 평형 공정이다. 이온화의 정도는 다양한 요인에 의해 영향을 받고, 과정은 다양한 화학적 및 생물학적 맥락에서 중요하다.