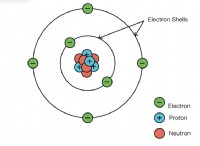
원자 질량은 단일 원자의 질량입니다. 이것은 원자에 모든 양성자, 중성자 및 전자를 추가하여 발견됩니다. 하나의 양성자의 질량은 1,836 개의 전자를 가지고 있습니다. 전자는 원자 질량의 결과를 간신히 바꾸지 않기 때문에 일반적으로 계산에서 제외됩니다. 이 튜토리얼은 상황에 따라 세 가지 다른 방법을 사용하여 원자 질량을 계산하는 방법을 보여줍니다.
1. 찾아보세요.
쉽게 들리지만 왜 이미 완료 되었습니까? 강사는 주기적 테이블 사용 방법을 가르 칠 때 원자 질량을 요구합니다. 원자 질량은 종종 주기성 테이블에 소수점 값으로, 일반적으로 요소 기호 또는 이름 아래에 나열됩니다. 이 숫자는 그들과 관련된 질량 단위가 필요합니다. 원자 질량은 일반적으로 원자 질량 단위 또는 AMU에서 제공됩니다.
1 AMU =1/12 하나의 탄소 -12 원자의 질량.
AMU의 일반적인 단위는 Dalton입니다. 하나의 달튼 =1 AMU. 이 두 장치는 상호 교환 적으로 사용할 수 있습니다. AMU 장치는 종종 화학에 사용되지 않습니다. 대신 원자 질량은 원소 원자의 한 몰에서 원소의 숫자 그램과 동일합니다. 이것에 대한 측정 단위는 그램/두더지 또는 간단히 g/mol입니다.
예 : 질소의 원자 질량을 찾으십시오.
질소는 원소 번호 7입니다. 주기율표를 사용하여 질소의 원자 질량은 14.01 amu 또는 14.01 g/mol입니다.
.2. 단일 원자에 중성자와 양성자의 수를 추가하십시오.
단일 원자의 질량이 필요한 경우 원자에서 양성자와 중성자의 수를 계산하십시오. 이것은 표준 원자 질량과 구별하기 위해 질량 수라고 불리는 것입니다.
예 : 8 중성자를 가진 탄소 동위 원소의 원자 질량은 얼마입니까?
탄소는 요소 6입니다. 요소의 원소 수는 원자 핵의 양성자 수입니다. 탄소에는 6 개의 양성자가 있습니다.
6 양성자 + 8 중성자 =14
이 탄소 동위 원소의 원자 질량은 14 amu입니다.
3. 요소의 모든 원자의 가중 평균 계산.
원자 질량은 풍부함에 따라 모든 요소의 동위 원소의 가중 평균에서 계산됩니다. 일반적으로 숙제 문제는 모든 동위 원소 목록, 질량 및 풍부 비율이있는 요소 샘플을 제공합니다. 이러한 문제를 해결하려면 다음과 같은 두 단계를 따르십시오.
1. 각 동위 원소의 질량에 풍부한 백분율을 곱하고 각 값으로 나누는 것은 100으로 나눕니다.
2.이 모든 값을 함께 추가하십시오.
예 : 75% 탄소 -12 및 25% 탄소 -14를 함유 한 탄소 샘플이 제공됩니다. 이 샘플의 평균 원자 질량은 얼마입니까?
Carbon-12부터 시작하겠습니다. Carbon-12는 샘플의 12. 75%의 원자 질량을 가지므로 탄소 -12이므로 원자 질량에 75를 곱합니다.
12 x 75 =900.
이 답을 100으로 나눕니다
900/100 =9
Carbon-14의 원자 질량은 샘플의 14.25% 가이 동위 원소였습니다. 동위 원소의 원자 질량에 25를 곱하십시오.
14 x 25 =350
이것을 100으로 나눕니다
350/100 =3.5
이 두 값을 함께 추가하십시오
9 + 3.5 =12.5
이 샘플의 평균 원자 질량은 12.5 amu입니다.
이것은 당신이 겪을 수있는 원자 질량 숙제 문제에 도움이 될 것입니다.