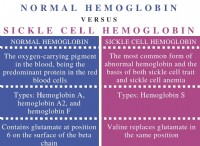
이유는 다음과 같습니다.
* 극성 : CaCl2는 이온 성 화합물이며, 이는 칼슘과 염소 원자 사이의 전자의 전달로 인해 양전하 및 음전하를 의미합니다. 물은 극성 용매이며, 이는 분자에서 전자의 고르지 않은 공유로 인해 양의 및 음성 및 부정적인 끝을 의미합니다. 물 분자의 양의 끝은 CACL2에서 음으로 하전 된 염소 이온을 유치 할 수있는 반면, 음성 말단은 양으로 하전 된 칼슘 이온을 끌어들일 수 있습니다. 이 매력은 물에 CaCl2의 용해로 이어진다.
* 솔루션의 엔탈피 : 물에서 CACL2의 용해는 열을 방출하여 유리한 과정을 나타냅니다. 이 에너지 방출은 물에서 CaCl2의 용해도에 더욱 기여합니다.
물은 CACL2의 가장 일반적인 용매이지만 다른 극성 용매에 용해 될 수 있습니다.
* 에탄올 (C2H5OH)
* 메탄올 (CH3OH)
* 글리콜 (hoch2ch2oh)
그러나, 그 용해도는 일반적으로 물에 비해 이러한 용매에서 낮다.