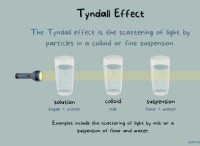
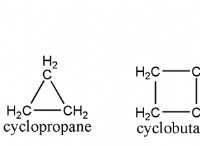
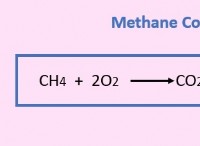
1. 100 그램 샘플을 가정하십시오
* 산화물이 질량으로 22.55% 산소를 함유하고 100 그램 샘플에서 22.55 그램의 산소가 있습니다.
2. 금속의 질량을 계산하십시오
* 100 그램 샘플의 나머지 질량은 금속입니다 :100 그램 -22.55 그램 =77.45 그램의 금속.
3. 산소의 두부를 결정하십시오
* 산소 질량을 몰 질량 (16.00 g/mol)으로 나눕니다. 22.55 g/16.00 g/mol =1.41 mol의 산소.
4. 금속의 두부를 결정하십시오
* 산화물에서 금속 대 산소의 비율은 특정 금속에 따라 다릅니다. 금속 77.45 그램이있을 때 1.41 몰의 산소가 발생하는 비율의 산화물을 형성하는 금속을 찾아야합니다.
* 예를 들어, 공식 Mo (여기서 M은 금속)를 가진 산화물을 고려해 봅시다 :
*이 경우 금속 대 산소의 비율은 1 :1입니다.
* 1.41 몰의 산소가 있으면 1.41 몰의 금속이 있습니다.
* 금속의 몰 질량을 찾기 위해 :77.45 그램 / 1.41 몰 =55.0 g / mol. 이것은 철 (Fe)의 몰 질량입니다.
5. 금속을 식별하십시오
* 단계 4에서 계산 된 금속의 몰 질량을주기 테이블과 비교함으로써 금속을 식별 할 수 있습니다.
중요한 고려 사항 :
* 산화물의 공식은 중요합니다 : 위의 예는 1 :1 비율 (Mo)을 가정했습니다. 다른 산화물은 상이한 금속 대 산소 비율을 갖는다 (예를 들어, M2O, MO2).
* 주어진 산소 백분율과 일치하는 다른 산화물 공식을 실험해야합니다.
특정 산화물 공식을 염두에두고 계산을 통해 금속을 식별하는 데 도움을 줄 수 있습니다. .