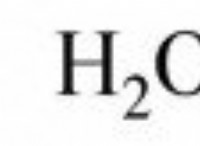x (g) + e⁻ → x⁻ (g) + 에너지
어디:
* x 중성 원자를 나타냅니다
* e⁻ 전자를 나타냅니다
* x⁻ 전자를 얻은 후 형성된 음으로 하전 된 이온 (음이온)을 나타냅니다.
* (g) 기체 상태를 나타냅니다
* 에너지 공정 중에 방출 된 에너지를 나타내며 발열 반응을 나타냅니다.
설명 :
* 중성 원자 : 중성 원자 X는 동일한 수의 양성자 및 전자를 가지므로 순 전하가 0입니다.
* 전자 게인 : 중성 원자가 전자를 얻을 때 음이온 (x⁻)을 형성하여 음으로 하전됩니다.
* 발열 과정 : 전자 게인의 공정은 에너지를 방출하여 시스템의 에너지가 감소합니다. 이 에너지 방출은 방정식의 "+ 에너지"용어로 표시됩니다.
예 :
염화물 원자 (CL)로부터의 클로라이드 이온 (CL⁻)의 형성은 발열 과정이다.
CL (G) + EAT → CL⁻ (G) + 349 kJ/mol
이 경우, 염소 원자가 전자를 얻을 때 349 kJ/mol의 에너지가 방출됩니다.