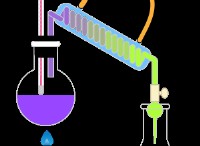
* 클로라이드 승화 : 화학적 과정으로서 "스 클로라이드"와 같은 것은 없습니다. 승화는 고체가 액체 상태를 통과하지 않고 가스로 직접 변하는 과정입니다. 일부 염화물은 (염화 암모늄, NH₄CL과 같은) 숭고 할 수 있지만,이 용어는 특정 반응을 설명하는 데 사용되지 않습니다.
* 염화나트륨 (NaCl) : 염화나트륨 (테이블 소금)은 정상적인 조건에서 쉽게 숭고하지 않습니다. 녹는 점은 끓는점보다 상당히 높습니다. 이를 승화시키기 위해서는 대부분의 화학 실험에 실용적이지 않은 매우 높은 온도와 압력이 필요합니다.
무슨 일이 일어나고 있는지
염화 암모늄 (NH₄CL)이 염화물 화합물을 생산하는 데 사용되는 반응에 대해 생각하고있는 것 같습니다. 이것이 일반적으로 작동하는 방식은 다음과 같습니다.
* 반응의 염화 암모늄 : 염화 암모늄은 종종 화학 반응에서 클로라이드 이온 (CL)의 공급원으로 사용됩니다. 이들 반응은 전형적으로 염화 암모늄의 클로라이드 이온이 다른 양이온 (양으로 하전 된 이온)과 반응하여 새로운 염화물 화합물을 형성하는 이중 변위 (metathesis) 반응을 포함한다.
예 :
염화 암모늄을 질산은 (Agno₃)과 반응하면 용액에서 염화은 (AGCL) 및 질산 암모늄 (NH₄NO₃)을 촉진시킵니다.
nh )cl (aq) + agno₃ (aq) → agcl (s) + nh₄no₃ (aq)
키 포인트 :
* 염화나트륨 (NaCl)은 일반적으로 염화물 화합물이 원하는 반응에서 염화 암모늄 (NH₄Cl) 대신 사용되지 않습니다. NaCl은 물에 덜 용해되기 때문에 클로라이드 이온을 방출하기 위해 쉽게 분해되지 않습니다.
* 반응에서 염화 암모늄을 대체하려는 경우 특정 반응을 고려하고 용해성과 원하는 방식으로 반응하는 클로라이드 염을 선택해야합니다.
당신이 생각한 특정 반응에 대해 더 많은 맥락을 제공 할 수 있는지 알려주십시오. 더 잘 이해할 수 있도록 도와 드릴 수 있습니다.