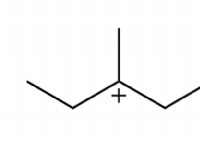
수소 결합 :
* hf : 불화 수소는 강한 수소 결합을 나타낸다. 이는 수소와 불소의 전기 음성 차이가 매우 크기 때문에 극성 결합을 생성하기 때문입니다. 플루오린의 작은 크기는 불소 원자의 고독한 전자 쌍과 이웃 HF 분자의 수소 원자 사이에 강한 정전기 상호 작용을 허용한다. 분자들 사이의 이러한 강력한 매력은 극복하기 위해 많은 에너지가 필요하므로 높은 끓는점이 필요합니다.
* HCl : HCl 결합에는 약간의 극성이 있지만 전기 음성 차이는 그리 중요하지 않습니다. 더 큰 크기의 염소는 또한 분자들 사이의 쌍극자 쌍극자 상호 작용을 약화시켜 HF에 비해 분자간 힘이 약해집니다.
요약 : HF에서 강한 수소 결합의 존재는 HCl에 비해 상당히 높은 끓는점의 주요 원인이다.