주요 차이 - 헥산 대 사이클로 헥산
헥산과 사이클로 헥산은 각각 6 개의 탄소 원자가있는 알칸입니다. 그러나, 헥산과 시클로 헥산의 주요 차이점은 분자 구조에있다. 헥산은 선형 탄소 사슬을 가지고 반면 사이클로 헥산은 주기적 분자입니다. 분자 구조의 주기적 배열로 인해, 사이클로 헥산은 헥산에 비해 수소 원자가 적다. 이러한 구조적 차이로 인해 헥산과 사이클로 헥산은 모두 고유 한 특성을 소유하고 있습니다.
이 기사는
1을 연구합니다. Hexane이란 무엇입니까
- 정의, 분자 구조, 특성, 사용
2. 사이클로 헥산
- 정의, 분자 구조, 특성, 사용
3. 헥산과 사이클로 헥산의 차이점은 무엇입니까? 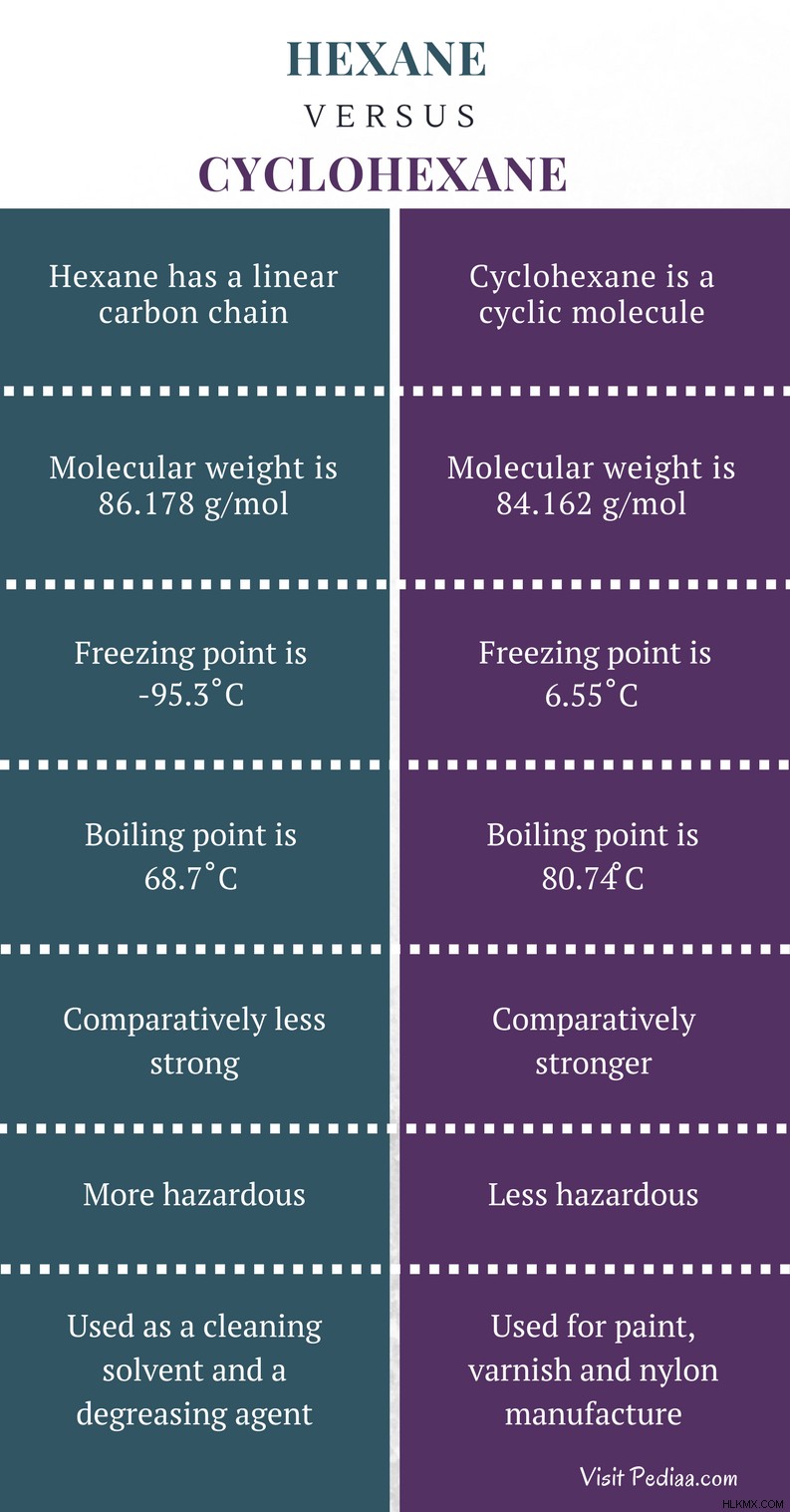
헥산이란 무엇입니까
6 개의 탄소 원자와 14 개의 수소 원자로 구성된 헥산의 분자식은 c 6 입니다. h 14 . 탄소를 연결하는 모든 채권은 단일 채권입니다. 따라서 헥산은 알칸이며 방해받지 않습니다. 헥산의 분자량은 86.178 g/mol.
입니다헥산, n-hexane 또한 유기 용매로 자주 사용되는 무색 액체입니다. 석유와 비슷한 냄새가납니다. 헥산은 68.7 ℃에서 끓고 -95.3 ℃에서 동결됩니다. 또한 가연성이 높고 증기 압력이 비교적 높습니다.
헥산은 비극성 용매이며 물과 혼합되지 않습니다. 그러나 알코올, 에테르, 클로로포름 및 아세톤과 같은 다른 유기 용매에 용해됩니다. 이것은 식물 오일 추출에 풍부하게 사용됩니다. 식물 오일은 비극성이 아니기 때문에 헥산으로 쉽게 용해됩니다. 또한 다양한 산업 분야에서 청소 용매 및 탈지제로 사용됩니다.

그림 1 :헥산의 분자 구조
헥산은 원유 파라핀 분획과 천연 가스의 일부이며, 이는 원유 정제 중에 65-70 ℃에서 분리됩니다. 폴리 비닐 클로라이드에 연소되어 방출됩니다. 인간 노출은 주로 피부 접촉 또는 흡입으로 인한 것입니다. 급성 노출은 눈 자극, 중추 신경계 우울증 및 증상은 메스꺼움, 두통, 멍청함 및 현기증을 유발할 수 있습니다. 만성 노출은 마비, 근육 약화, 시력이 흐려진 시력, 피로 및 두통으로 극한의 조건에서 다발성 병증을 일으킬 수 있습니다. 헥산은 발암 성으로보고되지 않았습니다.
사이클 성 사이클로 헥산
이름에서 알 수 있듯이 사이클로 헥산은 주기적 알칸입니다. 내부에는 여러 개의 채권이 없습니다. 시클로 헥산의 분자량은 84.162 g/mol입니다. 그것은 헥산에 비해 2 개의 수소 원자가 적고 분자식은 c 6 입니다. H 12 . 사이클로 헥산의 끓는점은 80.74 ℃ 인 반면, 동결 지점은 6.55 ℃입니다.
헥산과 유사하게 사이클로 헥산은 비극성 용매이며 물을 용해시키지 않습니다. 지방, 오일, 왁스, 래커, 수지 및 셀룰로오스 에테르와 같은 물질을 용해시키는 용매로 사용됩니다. 사이클로 헥산은 종종 향수 제조에 사용되며, 나일론 66 제조, 페인트 및 바니시 산업 등의 아디 피산 생산을 위해 사용됩니다.

그림 2 :사이클로 헥산 구조
cyclohexane은 비발적이고 가연성 액체입니다. 가벼운 눈 자극이지만 대량의 흡입은 중추 신경계 장애를 유발할 수 있습니다. 이것은 두통, 마취 및 경련과 같은 증상을 일으킬 수 있습니다. 사이클로 헥산은 주로 다양한 산업의 부산물로 환경에 방출됩니다. 광화학 스모그 형성을위한 도움 요소입니다.
헥산과 사이클로 헥산의 차이
분자식
헥산 : 분자식은 입니다 c 6 h 14
사이클로 헥산 : 분자식은 입니다 c 6 H 12
분자량
헥산 : 분자량은 86.178 g/mol
입니다사이클로 헥산 : 분자량은 84.162 g/mol
입니다동결 지점
헥산 : 동결 지점은 -95.3 ̊C
입니다사이클로 헥산 : 동결 지점은 6.55 ̊C
입니다비등점
헥산 : 끓는점은 입니다 68.7
사이클로 헥산 : 끓는점은 입니다 80.74
분자간 명소
헥산 : 헥산은 비교적 덜 강합니다.
사이클로 헥산 : 사이클로 헥산은 비교적 더 강합니다.
건강 위험
헥산 : 헥산은 더 위험합니다.
사이클로 헥산 : 사이클로 헥산은 덜 위험합니다.
사용
헥산 : 헥산은 청소 용매 및 탈지제로 사용됩니다.
사이클로 헥산 : 사이클로 헥산은 페인트, 바니시 및 나일론 제조에 사용됩니다.
결론
헥산과 사이클로 헥산의 주요 차이점은 구조적 배열에 있습니다. 헥산은 선형이고 사이클로 헥산은 주기적입니다. 또한, 헥산은 시클로 헥산보다 분자량이 약간 더 높다. 이것은 사이클로 헥산이 헥산에 비해 2 개의 하이드로겐이 적다는 사실 때문입니다.
사이클로 헥산을 차지하는 부피는 주기적 구조로 인해 헥산보다 낮습니다. 따라서, 헥산과 비교할 때 주어진 분자에서 더 많은 수의 시클로 헥산 분자가있다. 분자들 사이의 반 데르 발스 힘은 분자 사이의 거리에 반비례한다. 사이클로 헥산 분자는 밀접하게 포장되기 때문에 분자 상호 작용은 헥산의 분자보다 훨씬 강합니다. 따라서 본드를 깨고 증발하는 데 필요한 에너지가 훨씬 높습니다. 따라서, 사이클로 헥산은 더 높은 끓는점을 갖는다. 동결 지점 사이에도 큰 차이가 있습니다. 사이클로 헥산은 더 강한 분자 상호 작용으로 인해 쉽게 응축됩니다.
헥산과 사이클로 헥산은 많은 유사성을 가지고 있습니다. 그들은 눈에 똑같이 나타나고 비슷한 냄새가납니다. 둘 다 가연성입니다. 그러나 구조적 차이로 인해 위에서 논의 된 다른 속성이 있습니다.