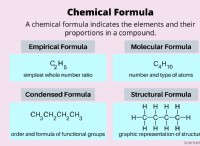
관계
* pH는 용액의 산도 또는 알칼리도의 척도입니다. 그것은 용액에서 수소 이온 (H+)의 농도에 기초합니다.
* H+ 이온의 농도가 높을수록 용액이 산성이 높고 pH가 낮아집니다.
* H+ 이온의 농도가 낮을수록 알칼리성이 많을수록 용액이 높고 pH가 높아집니다.
스케일
pH 척도는 로그이며, 즉 각각의 전체 수 변화는 수소 이온 농도의 10 배 변화를 나타냅니다.
* pH 7은 중성입니다 (예 :순수한 물).
7 미만의 pH 값은 산성이다 (예 :레몬 주스, 식초).
7 이상의 * pH 값은 알칼리성 (기본) 입니다 (예 :베이킹 소다 용액, 암모니아).
예
* H+ 농도의 증가 : 용액에서 H+ 이온의 농도가 두 배로 증가하면, pH는 하나의 단위 (예 :pH 4에서 pH 3에서 pH 3)만큼 감소합니다.
* H+ 농도의 감소 : 용액에서 H+ 이온의 농도가 10 배 감소하면, pH는 한 단위 (예 :pH 3에서 pH 4)만큼 증가합니다.
공식
pH와 수소 이온 농도 사이의 관계는 다음 공식으로 정의됩니다.
pH =-log [h+]
어디:
* [H+]는 리터당 몰의 수소 이온 농도 (M)입니다.
키 포인트
* pH 척도는 용액의 상대적 산도 또는 알칼리도를 표현하는 편리한 방법입니다.
* pH의 작은 변화조차도 화학 반응 및 생물학적 과정에 상당한 영향을 줄 수 있습니다.