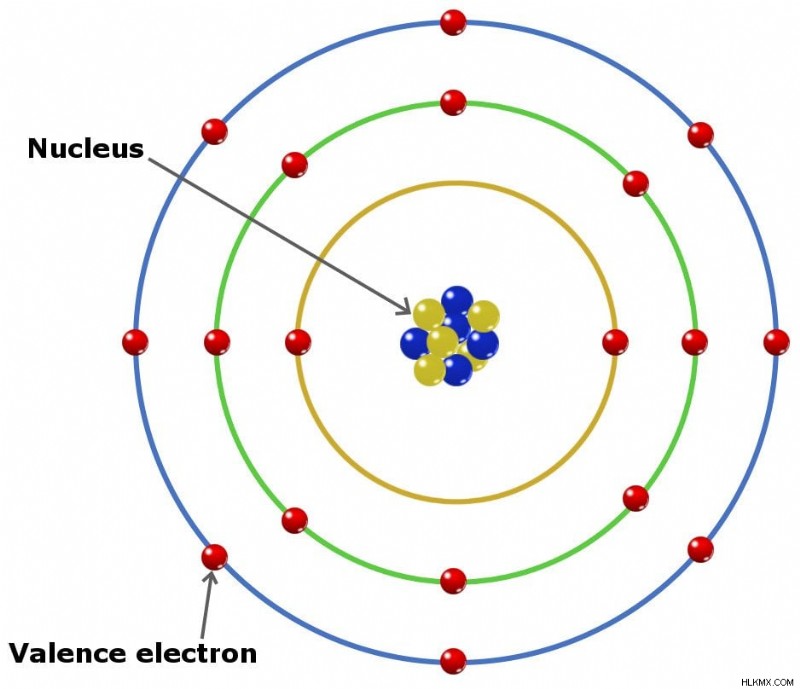
원자가 전자는 원자 핵을 둘러싼 가장 바깥 쪽 쉘에 존재하는 전자입니다. 원자가 전자는 요소의 화학적 특성에 대한 깊은 통찰력을 제공하기 때문에 매우 중요합니다. 전기 음성이든 전기 양성이든, 또는 화학 화합물의 결합 순서 - 두 원자 사이에 형성 될 수있는 결합의 수를 나타냅니다. .
공유 결합은 최종 쉘에서 전자 공유를 통해 형성되기 때문에, 그 수는 얼마나 많은 결합이 형성 될 수 있는지를 나타냅니다.
원자가 전자는 무엇입니까?
원자가 전자는 원자의 가장 바깥 쪽 쉘에 위치한 전자입니다. 다시 말해, 이들은 화학 반응 중에 얻거나 잃을 수있는 전자입니다.
원자가 전자는 어디에 있습니까?
원자 사이의 화학적 결합 유형에 관계없이, 이온 성, 공유 또는 금속 결합이든, 원자 구조의 변화는 가장 바깥 쪽 쉘의 전자, 즉 원자가 전자로 제한됩니다.
가장 기본적인 방법은 요소의 원자 구성을 참조하고 단순히 가장 바깥 쪽 쉘에 전자를 계산하는 것입니다. 그러나 우리가 모르는 구성을 찾기 위해 교과서를 파헤쳐 야 할 수도 있기 때문에 이것은 매우 힘든 일이 될 것입니다.
그러나이 탐욕스러운 숫자를 결정하는 것이 훨씬 간단하기 때문에 걱정할 필요가 없습니다. 이것은 하나의 작은 시설 직사각형 종이 시트 -주기적인 테이블을 소환하면 필요한보다 일반화 된 접근법입니다.
요소의 원자가 전자의 수를 결정하기 위해, 우리는 주기율표 만 참조하고 그 안에서 요소의 위치를 검색하면됩니다.
.원자가 전자 및주기적인 테이블
주기율표는 지금까지 발견 된 모든 요소의 깨끗한 배열입니다. 요소는 원자 번호의 오름차순으로 왼쪽에서 오른쪽으로 배열됩니다.
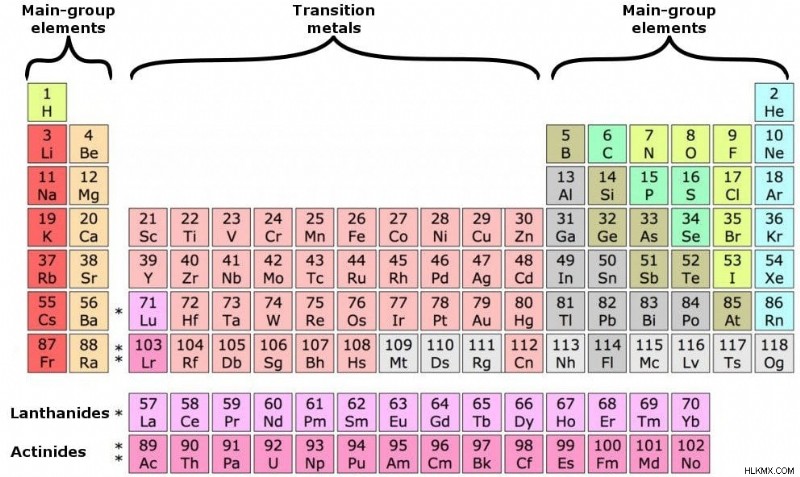
요소는 주요 그룹 요소, 전이 요소, 란타나이드 및 액티 나이드의 네 가지 범주로 나뉩니다. 후자의 두 사람은 또한 내부 전이 라고도합니다. 요소.
이 테이블에는 총 18 개의 열이 포함되어 있으며 공식적으로 그룹으로 알려져 있습니다. 공식적으로 기간으로 알려진 행뿐만 아니라 행. 위의 하위 테이블에는 7 개의 행이 있으며 아래는 아래의 드문 요소를 구별합니다. 전이 요소는 브리지를 형성하거나 그룹 2와 13의 요소 사이의 전환을 영속시킵니다.
원자가 전자를 찾는 방법?
우리가 그룹을 내려 가면 껍질의 수는 증가하지만 원자가 전자의 수는 동일하게 유지됩니다.
기간에 걸친 원자가 전자는 점진적으로 하나씩 올라가지 만 껍질의 수는 동일하게 유지됩니다. 요소를 찾을 수있는 기간 번호 (행 번호)는 핵을 둘러싸고있는 껍질의 수를 나타냅니다.
그렇다면 그룹 번호의 중요성은 무엇입니까?
단순히 주기율표를 참조하고 해당 그룹 번호를 결정하는이 방법은 한때 개별 원자 구성에 대한 힘든 검색과 함께 한 번거 로움과 복잡성을 제거했습니다.
그 사이의 요소의 원자가 전자는 어떻습니까? 물론 우리는 란타나이드와 액티 나이드를 잊지 말아야합니다…
껍질이 전자로 채워지는 방법에 대한 빠른 설명
전이 요소는 주요 그룹 요소에서 어깨에서 어깨로 이동하는 금속과 크게 다르지 않습니다. 그들은 금속과 매우 흡사합니다 :그들은 가단성, 연성이며 열과 전기를 모두 수행 할 수 있습니다. 최고의 두 도체 인 Cupper (CU)와 알루미늄 (AL)이 전이 금속이라는 사실은 특성이 겹치는 정도를 보여줍니다.
그러나 위의 방법에서 얻은 결과를 복제하지 않습니다. 우리는 단순히 그룹 번호를 참조하여 원자가 전자를 계산할 수 없습니다.
이 예외를 이해하려면 전자가 모든 에서 껍질을 차지하는 방법을 이해해야합니다. 요소.
그러나 먼저, 우리는 원자 핵 주위에 껍질을 채우는 고등학교 방법을 꺼내야합니다. 2..8..18 등을 기억하십니까? 글쎄, 우리 가이 특정 방식으로 전자를 분배하는 이유가 있습니다.
원자 주위의 전자 순서를 설명하는 태양계 비유는 완전히 잘못되었습니다. 그것은 즉시 제거되어야하지만, 법 ual 의 제시와 관련된 어려움을 완화하기 때문입니다. 모델, 고등학교 교과서는 주로이 기초적인 설명에 의존합니다.
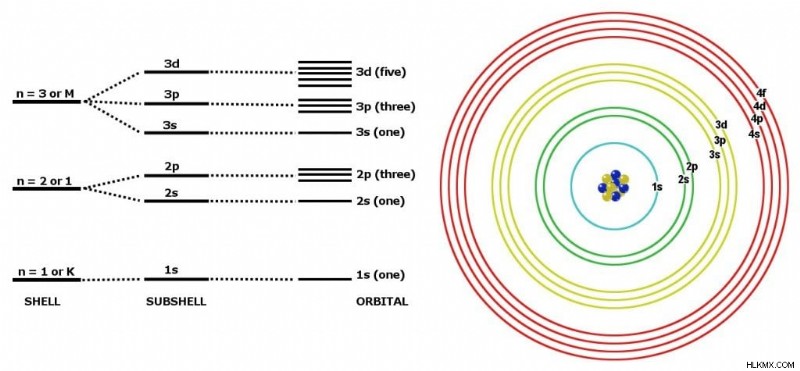
전자는 핵 주위에 강한 껍질을 차지하지 않습니다. 실제로, 핵 주위의 그들의 위치는 매우 불확실합니다. 그들은 핵 주위에 특정 에너지 수준만을 차지할 수 있습니다. 그들은 그곳에서 발견 될 가능성이 가장 높습니다. 기술적 으로이 수준은 양자 상태라고하며 소위 양자 수 n 에 의해 언급됩니다. .
이제 다음 문장은 위선적으로 들릴지 모르지만 양자 숫자는 우리의 좋은 껍질로 생각할 수 있지만 기술적으로 궤도 (S, P, D, F)로 알려진 하위 쉘로 생각할 수 있습니다. 이 지나치게 단순화에 관계없이, 그것은이과 같은 충돌 과정에 상당히 잘 어울립니다.
.서브 쉘이 수용 할 수있는 전자의 수를 제한하는 규칙이 있습니다 :S-2, P-6, D-10 및 F-14. 이것으로 충분하지 않은 경우 섬망에 추가하면 껍질을 아래에 주어진 특정 순서로만 채울 수 있습니다. 규칙 이라고합시다 .
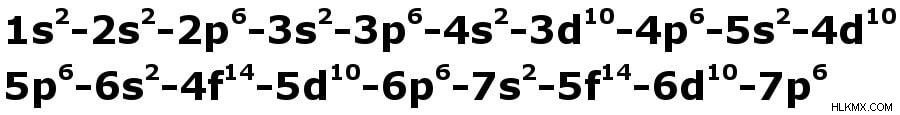
전자는이 순서로 왼쪽에서 오른쪽으로 만 채워야합니다.
위의 그림과 같이 서브 쉘이 어떻게 정렬되는지에 대해 무의식적으로 전자를 배포한다면, 원자 번호 20을 가진 칼슘 (ca)은 구성 2,8,10 (2, 2+6, 2+6+2)를 갖습니다. 고등학교 화학 교과서는 정확한 구성이 2,8,8,2이기 때문에 이것이 정확하지 않다고 말할 것입니다.
그러나 우리는 규칙을 준수해야하기 때문에 우리는 4가 3d 전에 채워져 있어야한다는 것을 관찰합니다 이제 3 번째 쉘에는 8 개, 4 번째 구성에는 2,8,8,2가 있습니다. 짜잔! Richard Feynman이 유쾌하게 외치는 것처럼 :사물을 찾는 즐거움! 슬프게도, 기쁨은 반 실생활입니다. rule 의 이유 그 자체 로이 명백한 부조리는이 기사의 범위를 벗어납니다.
좋아, 이제 우리는 껍질이 어떻게 채워 졌는지 알았으므로 전이 요소에서 원자가 전자의 수를 찾기 위해 더 나아갈 수 있습니다.
란타 나이드 및 액티 나이드의 원자가 전자 (전이 및 내부 전이 요소)
원자가 21의 스칸듐 (SC)을 고려하십시오. 우리의 규칙에 따라 전자를 채우십시오. 우리는 21 번째 전자가 3D 서브 쉘을 차지한다는 것을 관찰합니다. 그러나 이전에 채워진 4 번째 쉘 (4S)은 2 개의 전자를 가지며 분명히 가장 바깥 쪽 쉘이므로 원자가 전자의 수는 2입니다.
마찬가지로, 4 번째 기간의 모든 전이 요소에는 2 개의 원자가 전자가 있어야합니다. 3D가 4S보다 앞서 채워 지더라도 4 번째 쉘에 위치한 두 전자는 가장 바깥 쪽 껍질의 주민이며 원자가 전자의 지정을받을 자격이 있기 때문입니다.
실제로 이것은 모든 기간의 전환 요소에 적용됩니다. 6 번째 (행)와 11 번째 그룹 (열)에 위치한 Gold (AU)를 고려하십시오. 껍질을 채우는 과정에서, 5D의 먹거리에 이어 6s의 먹거리가 있다는 것을 깨달을 수 있습니다. 그리고 6 번째 쉘은 5 위에 상기이기 때문에 원자가 전자의 수는… *드럼 롤 *… 2!
입니다.그러나 이것은 전자가 이상적으로 이상적입니다 라인업. 이 껍질 사이의 에너지 차이는 미미하고 전자 (또는 그 문제에 대한 자연)는 다른 무엇보다도 안정성을 탐내합니다. 전자는 행복하게보다 안정적인 구성을 얻기 위해 비교적 등가 에너지의 인접한 쉘로 도약 할 것입니다.
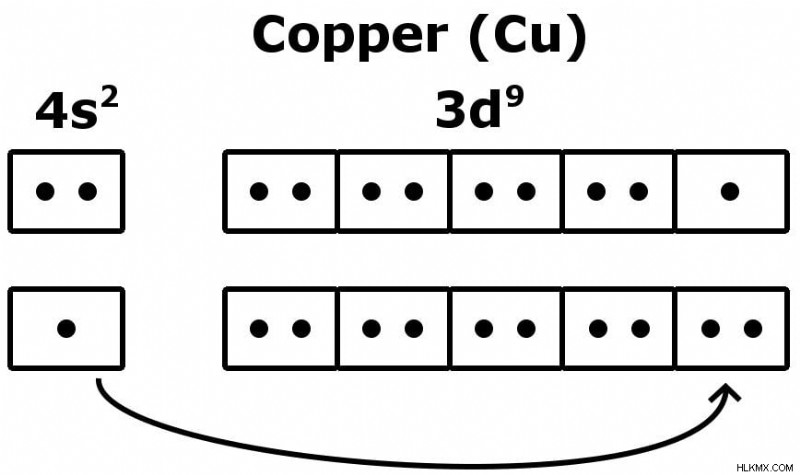
좋은 예는 구리 (Cu) 원자의 변덕스러운 구성입니다.
구리 원자가 전자의 호기심 많은 경우
구리에는 29 개의 전자가 있으므로 가장 후면 전자는… 4S2-3d9로 줄 지어 있습니다. 구리의 경우 구성은 약간 불안정합니다.보다 안정적인 구성은 3D 쉘에 10 개의 전자를 갖는 것이며, 이것이 우리가 관찰 한 것입니다!
.쉘의 에너지가 비슷하기 때문에 4S 전자는 안정적인 구성을 수행하기 위해 3D로 점프합니다. 원자가 전자의 수는 이제 1!
입니다
전이 요소들 사이의 다수의 요소는 이러한 이상한 점을 나타내며, 이는 F, D 및 S 쉘의 비슷한 에너지 수준으로 인해 내부 전이 요소에서도 관찰됩니다.
.요약하면, 전이 요소 및 내부 전이 요소에 대한 원자가 전자의 수는 예측할 수없는 방식으로 다양하다고 말할 수 있습니다.
전이 요소에 대한 원자가 전자의 수는 여전히 예측 될 수 있지만 대부분은 2로 끝납니다. 내부 전이 요소에 대한 그러한 예측은 모방 될 수 없습니다.
원자가 전자의 변덕스러운 동작, 끝없이 떨고 불확실한 호핑은 독특한 안정적인 구성을 얻으려는 시도를 거부합니다.