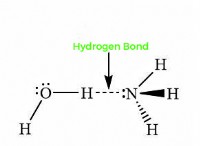
1. 전자 수 :
* 중성 황 원자 : 16 개의 전자 (원자 번호와 동일)가 있습니다.
* s² s 이온 : 18 개의 전자가 있습니다. 외부 쉘에서 안정적인 옥켓 구성을 달성하기 위해 2 개의 여분의 전자를 얻습니다.
2. 청구 :
* 중성 황 원자 : 순 전하 (동일한 수의 양성자 및 전자)가 없습니다.
* s² s 이온 : 양성자보다 전자가 2 개 더 있기 때문에 -2의 전하가 있습니다.
3. 전자 구성 :
* 중성 황 원자 : 1S² 2S² 2P⁶ 3S² 3P⁴ (외부 쉘에는 6 개의 전자가 있습니다)
* s² s 이온 : 1S² 2S² 2P⁶ 3S² 3P⁶ (외부 쉘은 이제 8 개의 전자, 안정적인 옥트가 있습니다)
4. 화학적 특성 :
* 중성 황 원자 : 화합물을 형성하기 위해 전자를 얻거나 잃을 수 있습니다.
* s² s 이온 : 부정적인 하전 종으로, 양으로 하전 된 이온에 끌릴 가능성이 높아져 이온 성 화합물이 형성 될 수 있습니다.
요약 : s² ⁻ 이온은 중성 황 원자가 2 개의 전자를 얻을 때 형성되어 외부 쉘에서 안정적인 옥켓 구성을 달성하고 음으로 하전 된 종이됩니다. 전자 구성 및 전하의 이러한 변화는 화학적 거동을 크게 변경합니다.