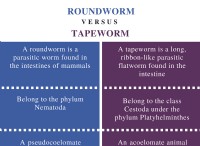
* 에탄 산은 약산이다 : 그것은 용액에서만 부분적으로 이온화되며, 이는 모든 수소 이온 (H+)을 기증하여 하이드로 늄 이온 (H3O+)을 형성하지 않습니다. 이로 인해 용액에서 농도의 전하 담체 (이온)가 낮아서 전도도가 낮아집니다.
* 염산은 강산입니다. 용액에서 완전히 이온화되는데, 이는 모든 수소 이온이 하이드로 늄 이온을 형성하기 위해 기증된다. 이것은 높은 농도의 전하 운반체를 생성하여 높은 전도도를 초래합니다.
여기에 고장이 있습니다 :
* 에탄 산 : CH3COOH h CH3COO- + H +
* 평형은 왼쪽에 놓여 있으며, 이는 대부분의 산이 해제되지 않은 채 남아 있음을 의미합니다.
* 히드로 클로르 산 : HCL → H + + CL-
* 완전한 이온화, 모든 HCl 분자는 이온으로 분리됩니다.
요약 : 이온화 정도는 용액에서 전하 담체의 농도를 결정한다. 더 높은 농도의 이온은 전기 전도성을 높입니다. 약산 인 에탄 산은 강산 인 염산에 비해 이온의 농도가 낮습니다.