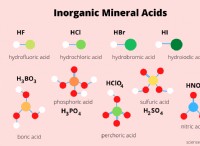
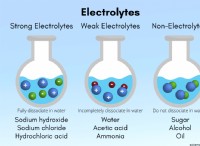
다음은 고장입니다.
* Brønsted-Lowry 이론 산을 양성자 공여자로 정의합니다 및 양성자 수용체로서의 염기 .
예를 들어 이것을 설명해 봅시다.
* HCl (염산) 히드로 늄 이온 (H3O+) 및 클로라이드 이온 (CL-)을 형성하는 물 (H2O)에 양성자 (H+)를 기증한다.
* nh3 (암모니아) 암모늄 이온 (NH4+) 및 수산화 이온 (OH-)을 형성하는 물 (H2O)으로부터 양성자 (H+)를 수용한다.
대조적으로, Arrhenius 이론과 같은 다른 정의는 산에 의한 염기 및 수소 이온 (H+)에 의한 수산화물 이온 (OH-)의 형성에 초점을 맞추고있다. 유용하지만 Arrhenius 이론은 수용액으로 제한됩니다. 반면에 Brønsted-Lowry 이론은 더 일반적이며 더 넓은 범위의 반응에 적용될 수 있습니다.