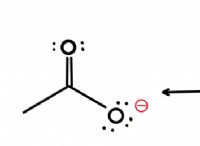
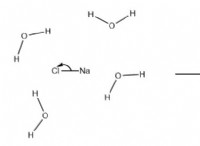
이온 성 화합물
* 극성 : 물은 극성 분자이며, 이는 약간 양의 말단 (수소)과 약간 음의 끝 (산소)을 갖는다는 것을 의미합니다. 이 극성은 이온 성 화합물을 용해시키는 데 중요합니다.
* 상호 작용 : 염 (NaCl)과 같은 이온 성 화합물이 물에 첨가 될 때, 물 분자의 양의 수소 끝은 음성 클로라이드 이온 (Cl-)에 끌리고, 물 분자의 음성 산소 끝은 양성 나트륨 이온 (Na+)에 끌린다.
* 용해 : 이 관광 명소는 결정 격자에서 나트륨과 염화물 이온을 함께 고정하는 정전기력을 극복합니다. 물 분자는 이온을 둘러싸고 분리하여 용액으로 당깁니다.
공유 화합물
* 극성이 중요합니다 : 물은 극성 공유 화합물 (전자의 고르지 않은 공유 화합물) 만 용해시킬 수 있습니다. 이것은 극성 분자와 수소 결합을 형성 할 수 있기 때문입니다.
* 용해도 : 비극성 공유 화합물 (전자 공유조차도)은 일반적으로 물에 용해되지 않습니다. 기름과 물을 생각해보십시오-오일은 비극성 공유 화합물이며 물과 혼합되지 않습니다.
다음은 다음을 요약 할 빠른 테이블입니다.
| 화합물 유형 | 물이 녹는 방법 |
| --- | --- |
| 이온 성 | 물의 극성은 이온을 끌어 내고 이온 결합을 깨뜨립니다. |
| 공유 (극) | 물은 극성 분자와 수소 결합을 형성합니다. |
| 공유 (비극성) | 일반적으로 물에 용해되지 않습니다. |
키 포인트 :
* "처럼 녹는 것처럼": 물과 같은 극성 용매는 극성 화합물을 용해시키고 비극성 용매는 비극성 화합물을 용해시킨다.
* 수소 결합 : 극성 분자와 수소 결합을 형성하는 물의 능력은 용해 능력의 중요한 요소입니다.
* 명소의 힘 : 이온 성 화합물에 이온을 함께 고정하는 힘의 강도와 물 분자와 이온 사이의 힘의 강도는 화합물의 용해도를 결정합니다.