핵심 개념
이 기사에서는 배경 화학 및 역학을 포함하여 가수 분해의 기본 사항을 배웁니다. 또한 생체 분자를 사용한 예일뿐만 아니라 가장 중요한 메커니즘의 단계별 메커니즘을 배울 것입니다.
물의 반응성
우리는 종종 물 (H2O)을 지루하고 단순하며 압도적이라고 생각하는 것을 좋아합니다. 결국, 그것은 맛도 없습니다! 때때로 홍수, 쓰나미 또는 립데이드를 위해 물은 생물학과 지질학의 기본이지만, 약간의 불활성이고 위협적이지 않은 액체처럼 보입니다.
그러나 화학에 대한 이해로 흥미 진진한 물의 힘은 해방됩니다. 특정 화합물과 접촉 할 때, 물은 금속을 부식시키고 살을 화학적으로 연소시킬 수있는 산성 또는 기본 용액을 형성 할 수 있습니다. 특정 금속 양이온과 접촉 할 때, 물은 리간드로서 작용하여 화려하게 착색 된 염 단지를 생성 할 수 있습니다. 오늘날의 주제와 관련하여 물은 또한 염과 유기 화합물의 구조를 근본적으로 변경하여 유기 합성 및 생화학 시스템에서 중요한 시약이 될 수 있습니다.
.물의 유용성은 가장 기본적인 특징 인 극성 구조에서 비롯됩니다. 이러한 극성으로, 물은 유기 반응에서 친 핵성 역할을하고 전기성으로 작용할 수있다. 환경으로 물을 사용하는 가장 중요한 종류의 유기 반응은 "가수 분해"라는 이름으로 간다. 가수 분해의 정의는 물과의 반응을 통한 화학적 결합의 파괴입니다. 중요하게도, 이온 성 결합과 고도로 극성 결합만이“가수 분해”할 수 있습니다.
가수 분해 메커니즘을 면밀히 살펴 보겠습니다.
가수 분해 란 무엇입니까?
염 가수 분해
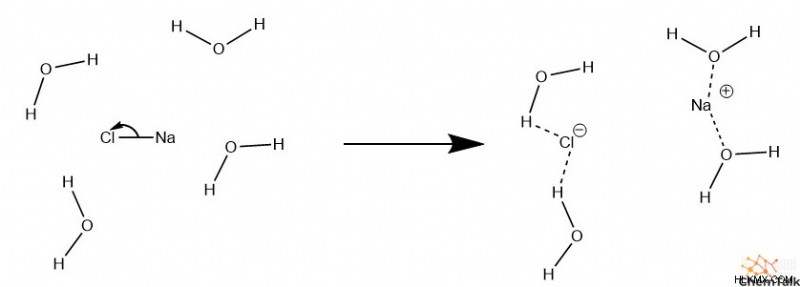
가수 분해에 대한 가장 기본적인 메커니즘은 수소 결합 만 포함됩니다. 전형적으로,이 메커니즘은 소금의 결합과 같은 이온 성 결합만을 깨뜨린다. 중요하게도,이 메커니즘은 테이블 소금 인 NaCl이 액체 물에 버릴 때 발생하는 메커니즘입니다. 양의 이온과 음성 이온이 물의 극성 영역에보다 정전 기적 인력이 더 높은 경우 소금의 이온 결합이 파손될 수 있습니다. 이온 결합이 약한 소금은 따라서 더 "용해성"이거나 물 용매에서 더 쉽게 분해되는 경향이 있습니다.
유기농 가수 분해
유기 화합물의 가수 분해 메커니즘은 조금 더 복잡합니다. 가수 분해는 산 촉매 또는 염기 촉매 조건에서 발생할 수 있지만, 메커니즘은 각각에 대해 약간 다릅니다. 일반적으로, 가수 분해는 아미드 및 에스테르에서만 발생하며, 이들 기능 그룹만이 충분한 극성 특성을 갖기 때문이다. 아미노와 카르복시 그룹은 각각 전기 음성 잎 그룹으로 사용됩니다.
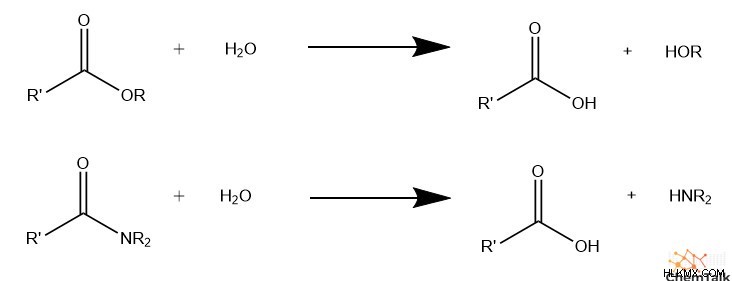
유기 가수 분해는이 기본 반응 방정식을 따릅니다.
CE + H 2 o → Coh + He
E :전기 음성 잎 그룹, 종종 아미노 또는 카르복시
C :전기 양성 그룹, 종종 카르 보닐
산 촉매 가수 분해
산 촉매 메커니즘에서, 첫 번째 단계는 카르 보닐과 잎 그룹을 양성하는 물 또는 일부 제네릭 산과 관련하여 양성을 갖는다.
.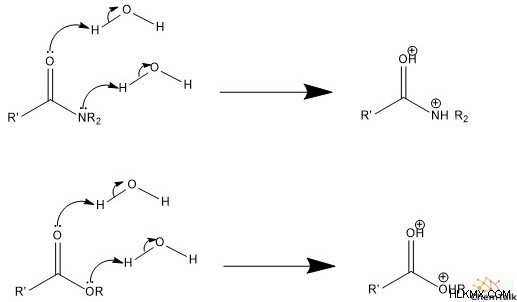
둘째, 물은 탄소를 공격하여 친핵체 역할을합니다. 이것은 카르 보닐에 관여하는 PI 결합 전자를 인접한 산소로 밀어내어 양전하를 중화시킨다. 셋째, 공격적인 물 그룹은 물 또는 일부 일반 염기에 의해 탈 양성자 화되어 diol (2- 알코올) 종을 생성합니다.
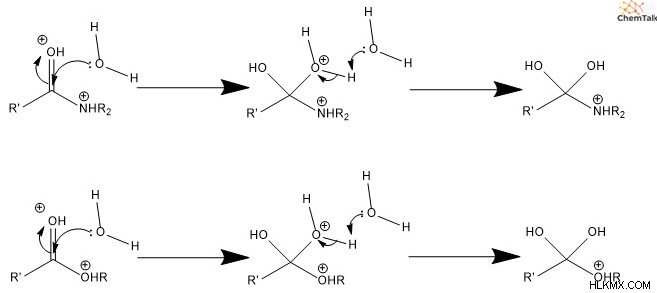
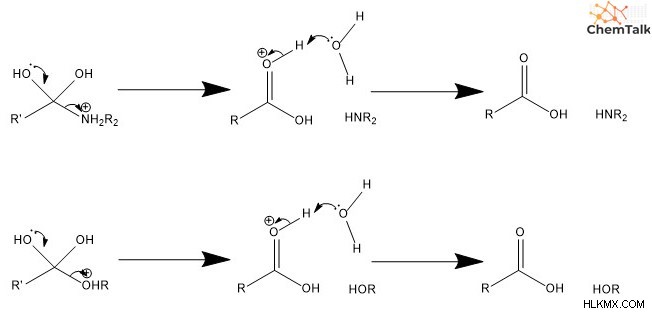
넷째, Diols 중 하나는 카르 보닐로 전환됩니다. 여기에는 탄소와 이중 결합을 형성하여 산소에 자유 전자 쌍이 포함되어 떠나는 그룹을 밀어냅니다. 다섯째, 새로 형성된 카르 보닐은 탈 양성자 화되어 중성으로 간주 된 카르 복실 산을 초래한다.
.
염기-촉매 가수 분해
염기-촉매 메커니즘에서, 첫 번째 단계는 물 또는 일부 수산화탄소가 탄소를 공격하여 전자 쌍을 카르 보닐 산소에 밀어 넣는다. 물이 공격 종으로 작용한다면 빠르게 탈 양성자가됩니다. 둘째, 산화물 그룹은 카르 보닐로 개혁되어 떠나는 그룹을 밀어내어 중성으로 충전 된 카르 복실 산을 초래한다.
.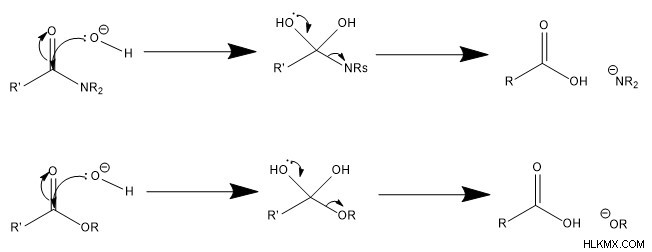 생체 분자 의
생체 분자 의 가수 분해
유기체에서, 생체 분자는 일반적으로 산 및 염기 촉매 가수 분해에 대한 메커니즘을 따릅니다. 유기체에서, 가수 분해 효소라고하는 중요한 효소는 이들 가수 분해 반응을 촉진시킨다. 중요하게도, 가수 분해는 큰 중합체 분자를 분해하는 주요 수단으로 작용한다. 이런 식으로, 많은 사람들은 가수 분해를 탈수 합성의 반대라고 생각하며, 이는 응축 반응을 통한 중합체를 구축하는 것을 포함한다. 생체 분자에서 가수 분해의 가장 중요한 예를 살펴 보겠습니다.
H ydrolyzing 탄수화물
2 개의 단당 단량체를 분리하려면, 글리코 시드 결합을 파괴하기 위해 가수 분해 반응이 발생해야한다. 중요하게도, 이들 결합은 카르 보닐기를 포함하지 않으므로, 대신 이전 메커니즘의 변형 된 버전이 일어난다.
산 및 염기 촉매 가수 분해가 모두 발생할 수있다. 산-촉매 화 된 탄수화물 가수 분해에서, 글리코 시드 결합의 산소는 양성자 화된다. 그런 다음 물은 친핵체 역할을하고 탄수화물 중 하나를 공격하여 탄수화물 사이의 결합을 깨뜨립니다. 그런 다음 공격 물이 탈 양성자 화되어 산 촉매를 완료합니다.
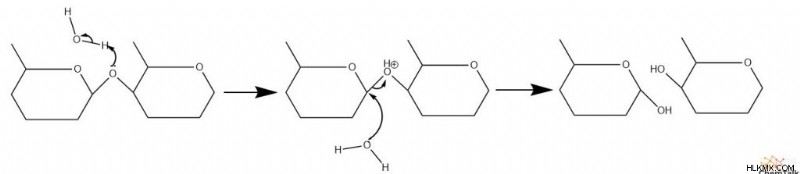
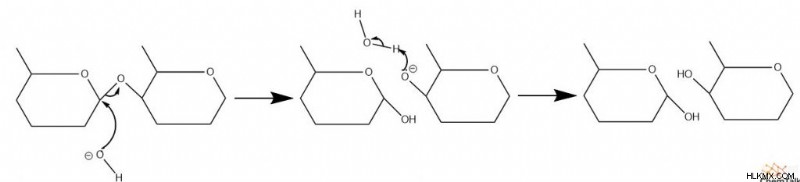
기본 촉매 메커니즘은 다소 유사하다. 수산화물은 탄소를 공격하여 글리코 시드 결합을 깨뜨립니다. 나머지 산화물은 양성자 화됩니다.
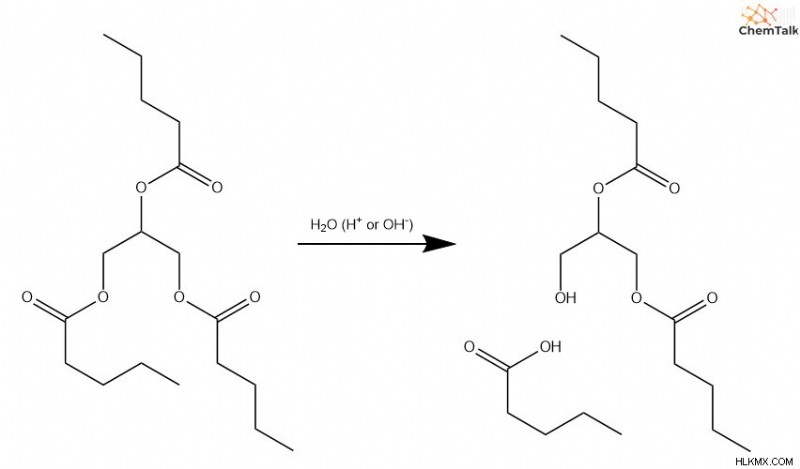
H ydrolyzing 지질
트리글리세리드 또는 인지질을 분해하기 위해, 유기체는 가수 분해 반응을 수행하여 지방산과 글리세롤 사이의 결합을 파괴한다. 이들 결합은 에스테르 그룹을 포함하기 때문에, 우리가 다루는 산 및 염기- 촉매 메커니즘은 이들 가수 분해가 어떻게 발생하는지 완전히 설명한다.
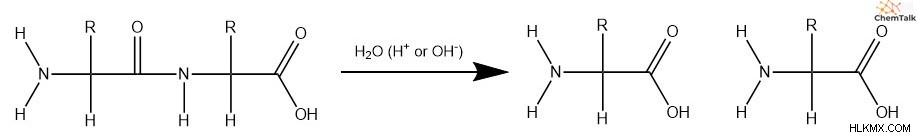
H ydrolyzing 단백질
단백질을 분해하려면, 아미노산 사이의 펩티드 결합을 파괴하기 위해 가수 분해 반응이 발생해야한다. 지질과 마찬가지로, 펩티드 결합은 아미드 그룹을 포함하기 때문에 이전 메커니즘은 이러한 반응을 설명하는 데 효과적입니다.
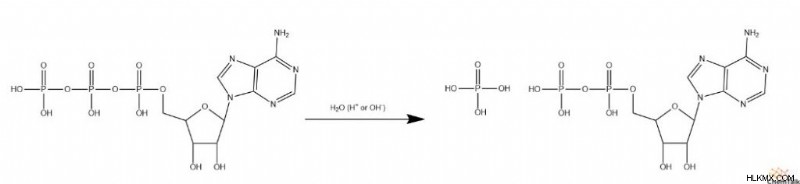
H ydrolyzing ATP
ATP의 인산염의 가수 분해는 불리한 생화학 적 반응에 대한 에너지를 제공하는 데 중요한 역할을합니다. 다른 가수 분해 예와 달리 ATP에는 탄소가 포함되지 않는 메커니즘이 포함됩니다. 대신, 파손되는 극성 결합은 산소와 인 사이의 포스 포 디 에스테르 결합이다. 산 및 염기 촉매 화 된 메커니즘은 여전히 넓게 발생하지만 인은 탄소를 완전히 대신합니다.