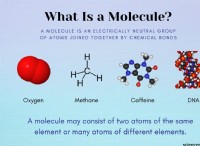
1. hocso₄ 의 해리를 이해하십시오
황산 (HASSOA)은 강한 디 프로산으로, 용액에서 분자 당 2 개의 양성자 (HAT)를 기증한다는 것을 의미합니다. 해리는 두 단계로 발생합니다.
* 첫 번째 해리 : h₂so₂ → h₄ + hso₄⁻ (이 단계는 본질적으로 완료됩니다)
* 두 번째 해리 : hso⁺ ⁺ h⇌ + so₄²⁻ (이 단계는 부분적으로 가역적입니다)
2. h concentr 이온의 농도를 계산하십시오
* 첫 번째 해리 : 첫 번째 해리가 완료되기 때문에, 초기 0.01 m h₂so₄는 0.01 m h⁺ 이온을 생성합니다.
* 두 번째 해리 : HSO₄⁻의 두 번째 해리는 덜 완료되지만, 초기 HAL의 농도는 이미 높기 때문에 (0.01m), 우리는이 단계로부터의 H⁺의 기여가 무시할 수 있다고 합리적으로 가정 할 수있다.
3. pH를 계산하십시오
* pH =-log [H⁺]
* H⁺ 농도 대체 :pH =-log (0.01) = 2
따라서, 2 리터의 0.01 m h₂so₄ 용액의 pH는 대략 2입니다.
중요한 참고 : 이 계산은 솔루션의 부피가 2 리터라고 가정합니다. 최종 볼륨이 다르면 그에 따라 HASSO₄의 농도를 조정해야합니다.