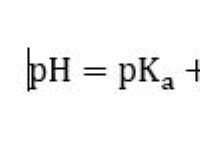유사성 :
* 둘 다 솔루션에서 전기를 전도 할 수 있습니다 : 산은 물에 용해 될 때 전기의 흐름을 허용하는 이온 (H+ 및 음이온)을 형성합니다. 이온 성 화합물은 또한 용액에서 이온으로 분리되어 전도성을 만듭니다.
* 둘 다 정전기 상호 작용을 포함합니다 : 이온 성 화합물의 결합은 반대로 하전 된 이온 사이의 정전기 인력에 의해 형성된다. 산은 순전히 이온 성이 아니지만 산성 양성자 (H+)와 분자의 음으로 하전 된 부분 사이의 정전 기적 상호 작용을 포함한다.
차이점 :
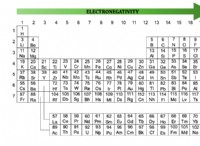
* 본딩 : 이온 성 화합물은 이온 사이에 강한 정전기 결합을 형성하는 반면, 산은 일반적으로 분자 내에서 공유 결합을 갖는다. 산성 양성자는 일반적으로 산소와 같은보다 전기 음성 원자에 부착되어 편광 된 결합과 양성자를 방출하는 경향이 있습니다.
* 형성 : 이온 성 화합물은 원자 사이의 전자의 전달에 의해 형성되어 양이온 및 음이온의 형성을 초래한다. 산은 수소 원자와 비금속 또는 다 원자 음이온의 조합에 의해 형성된다.
* 반응 : 산은 반응에서 양성자 (H+)를 기증하는 경향이 있으며, 염과 물의 형성으로 이어진다. 이온 성 화합물은 이온을 교환함으로써 반응하여 새로운 이온 성 화합물의 형성을 초래한다.
요약 : 산 및 이온 성 화합물은 용액에서 전기를 전도하고 정전기 상호 작용을 포함 할 수 있지만, 결합, 형성 및 반응 메커니즘이 다릅니다.
"산"및 "이온 성 화합물"이라는 용어는 광범위한 범주라는 점에 유의해야합니다. 각 범주에는 예외와 변형이있어 일반화하기가 복잡합니다.