핵심 개념
이 기사에서는 열역학 및 응용을 포함한 융합 열에 대해 배우게됩니다. 이 기사 후에는 융합 열의 특성을 이해하고 열 화학 문제를 해결하는 데 사용할 수 있습니다.
융합의 열은 무엇입니까?
융합 엔탈피 또는 융합의 열열이라고도 불리는 융합의 열은 일정한 압력 조건 하에서 물질을 녹이거나 얼리는 데 필요한 에너지의 양입니다. 화학을 연구 할 때“Fusion”은 단순히 녹는 것과 동일한 정의를 가지고 있습니다. 교실에서는 물질이 녹는 지점이나 얼어 붙은 지점에있을 때 주로 융합 열을 사용합니다. 그러한 경우, 대부분은 융합 열을 일정하게 생각합니다.
예를 들어, 물은 융점 0 ° C에서 334 j/g의 융합 열이 있습니다. 이것은 0 ° C에서 1 그램의 액체 물이 334 개의 에너지를 방출하여 얼음으로 완전히 얼어 붙어야 함을 의미합니다. 또한, 1 그램의 얼음은 0 ° C에서 완전히 녹기 위해 334 줄의 에너지를 흡수해야합니다.
다음의 퓨전 열을 사용하여 용융점에서 물질의 단계를 변경하는 데 필요한 열 에너지의 양을 계산할 수 있습니다.
q =m∆hf
Q :열 에너지의 총 변화 (줄로)
∆HF :물질 융합 열 (그램 당 줄로)
M :물질의 질량 (그램)
융합의 어금니 열
물질의 몰 질량을 알고 있다면 융합의 몰 열로 쉽게 변환 할 수 있습니다. 물의 몰 질량은 18.02 g/mol의 몰 질량을 가지므로, 융합의 몰 열은 6020 J/mol (334*18.02 =6020)입니다. 결과적으로, 에너지의 총 변화를 계산하려면 대신 질량 대신 두더지를 사용해야합니다.
q =n∆hf
N :물질의 두부
퓨전의 열은 물질이 온도를 변화시키지 않고 에너지를 흡수하거나 방출 할 수 있음을 시사하기 때문에 관심있는 화학자와 물리학자가 있습니다. 실제로, 0 ° C에서 1 몰의 얼음이 6020 줄의 열을 흡수 할 때, 생성 된 액체 물은 또한 0 ℃의 온도를 가질 것이다. 이 현상의 특수성을 이해하려면 먼저 위상 변화와 관련이없는 에너지 변화에 대해 이야기해야합니다.
물질은 일반적으로 온도가 어떻게 변합니까?
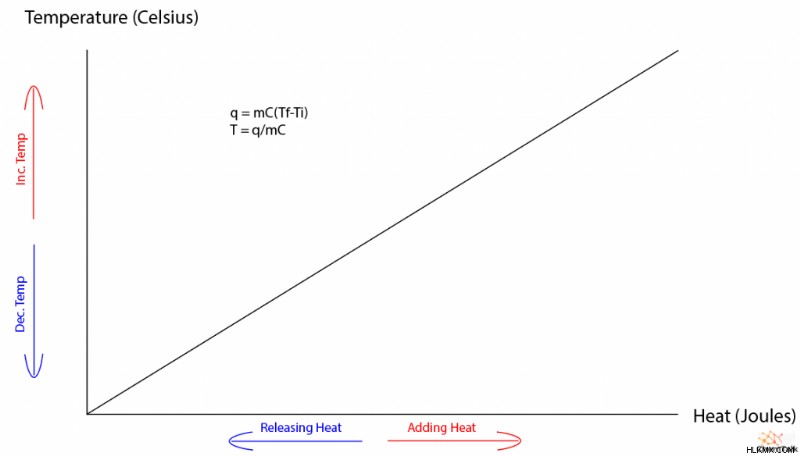
일반적으로, 물질이 열 에너지를 흡수하거나 방출 할 때, 온도는 반응이 변합니다. 온도 변화의 양은 물질의 비열에 의해 지배되는데, 이는 물질에 고유 한 품질이며 물질의 양에 의존하지 않습니다. 다음 방정식은 열 에너지, 비열 및 온도의 관계를 자세히 설명합니다.
Q =mc∆t
Q :열 변화 (줄로)
M :물질의 질량 (그램)
C :물질의 비열 (섭씨 학위 당 그램 당 줄로)
∆t :온도 변화 (섭씨도)
이런 식으로, 당신은 비열을 섭씨 1 그램으로 1 그램으로 바꾸는 데 필요한 에너지의 양이라고 생각할 수 있습니다. 예를 들어, 금의 비열은 0.128 j/g ° C입니다. 이것은 1 그램의 순수 금이 0.128 줄의 에너지를 흡수 할 때 1 ° C로 가열됩니다. 반대로, 0.128 줄의 에너지가 금에서 추출 될 때, 그 온도는 1 ° C로 낮아집니다. 비열을 사용하는 방법에 대한 자세한 내용은이 기사를 확인하십시오.
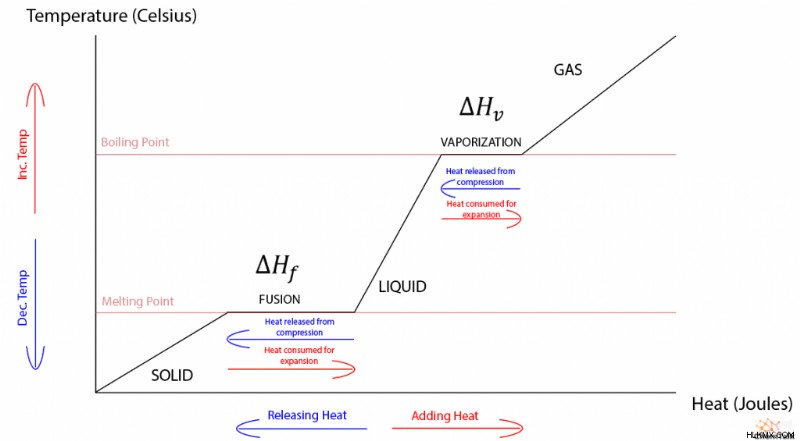
온도와 열은 직접적으로 비례 관계를 갖기 때문에 위상 변화가없는 물질의 열 대 온도 그래프는 선형입니다. 그래프에 위상 변화가 포함될 때, 이상한 조각 별 경사가 녹는 것과 기화에 해당하는 평평한 스트레칭으로 나타납니다. 참고로, 가스와 액체 사이의 위상 변화는 융합 열에 동일하게 기능하는 "기화 열"에 의해 지배된다.
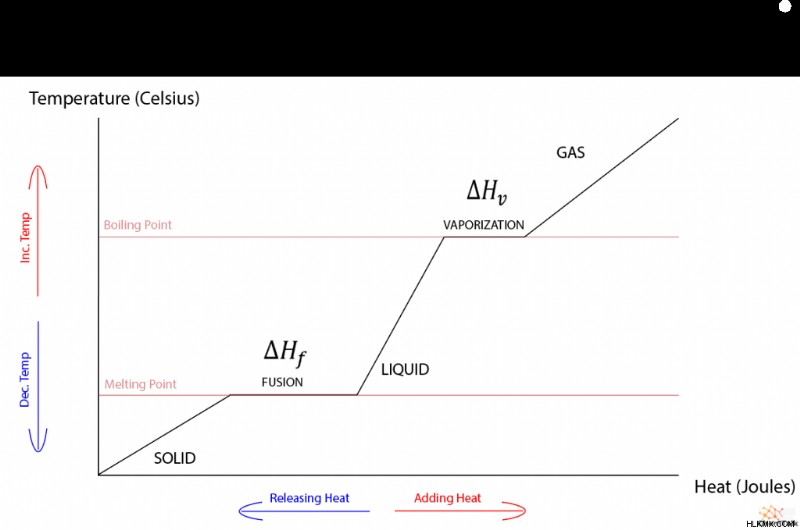
따라서 온도와 열 에너지가 일반적으로 직접적인 관계가 있다는 점을 감안할 때 위상 전이 중에 온도가 변하지 않는 이유는 무엇입니까? 이유를 이해하려면 위상 전이의 열역학을 조사해야합니다.
퓨전 열 뒤에 열역학
온도 및 내부 에너지
첫째, 우리는“온도”가 실제로 무엇을 의미하는지 이야기해야합니다. 화학자와 물리학자는 온도를 물질 분자 당 평균 운동 에너지로 정의합니다. 운동 에너지는 입자의 질량과 속도에 따라 다릅니다. 물질을 가열하는 것은 분자 질량의 변화를 포함하지 않기 때문에 분자의 속도 만 변합니다. 따라서 물질이 열 에너지를 흡수하면 분자가 더 빨리 움직여 온도가 증가합니다.
중요하게도, 시스템의 온도는 시스템의 내부 에너지라고 불리는 수량에 비례합니다. 따라서 시스템 온도의 변화는 내부 에너지의 비슷한 변화를 포함합니다.
열역학의 첫 번째 법칙에 따르면 시스템 ()의 내부 에너지의 변화는 시스템에 의해 또는 시스템에서 또는 흡수되고 작업이 주어진 열의 합계와 같다고합니다.
∆U =Q + W
∆U :내부 에너지; 온도 증가에 양성, 온도 감소에 대한 음수 (줄로)
Q :열; 열 흡수에 대한 양성, 방출 된 열에 대한 음수 (줄무늬)
W :일; 시스템에서 수행 된 작업에 대해 긍정적, 시스템이 수행 한 작업에 부정적인 (Joules
작업
일반적으로 용기에서 일부 물질을 다룰 때 물질이 수행 할 수있는 유일한 작업은 확장 또는 압축 작업입니다. 여기에는 외부 압력과 또는 외부 압력에 대한 물질 변화 부피가 포함됩니다. 그러나 가스만이 상당한 팽창 또는 압축을 수행 할 수 있으며 열은 가스의 내부 에너지를 유지하기 위해 반대로 작용합니다. 예를 들어, 가스 (양의 열)를 가열 할 때 가스가 팽창하여 (음성 작업) 내부 에너지의 변화가 없습니다. 또한 가스를 압축 할 때 (양성 작업) 가스는 열 에너지 (음성 열)를 방출합니다.
가스와 달리, 액체 및 고체는 가열되거나 냉각 될 때 부피가 크게 변하지 않습니다. 액체 또는 가스가 가열되거나 냉각되면 사실상 작업이 수행되지 않습니다. 따라서 열 흡수는 물질의 내부 에너지를 증가시켜 온도를 높입니다.
그러나 액체와 고체는 단계를 바꿀 때 0이 아닌 작업을 경험합니다. 이것은 분자가 종종 액체 형태보다 단단한 형태로 서로 가깝기 때문입니다. 결과적으로 액체로의 고체 용융은 팽창을 수행해야하며 액체는 압축을 위해 압축해야합니다.
이 현상은 융합 열의 특성을 정확하게 설명합니다. 고체가 융점으로 가열되면, 고체에 입력 된 더 많은 열 에너지가이를 액체로 확장하는 데 사용됩니다. 따라서, 물질의 열과 작업은 서로 대응하여 내부 에너지의 변화가 없어서 물질이 완전히 액체가 될 때까지 용융점에 머무를 수있게한다.
.