주요 차이 - 분자 대 구조적 공식
분자식 및 화합물의 구조식은 화합물에 존재하는 다른 화학 요소의 원자를 나타냅니다. 분자식은 이들 요소들 사이의 비율을 제공한다. 구조 공식은 이들 원자의 상대적 위치를 제공한다. 분자 공식과 구조식의 주요 차이점은 분자식 공식이 원자의 상대 위치를 나타내는 반면 구조적 공식은 원자의 상대 위치를 나타냅니다.
주요 영역을 다루었습니다
1. 분자식
- 정의, 분자식 찾기
2. 구조 공식이란 무엇입니까
- 정의, 사용
3. 분자와 구조 공식의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :응축 공식, 경험적 공식, 루이스 구조, 분자 공식, 구조 공식

분자식
화합물의 분자식 또는 화학적 공식은 원자의 유형과 해당 화합물에 존재하는 비율의 표현입니다. 분자 공식은 화학 요소의 상징과 그 사이의 비율을 나타내는 숫자에 의해 주어집니다. 이 비율은 실제 원자 수입니다 (가장 간단한 수는 경험적 공식으로 제공됩니다).
분자식은 단순 분자의 명명법에 사용될 수 있지만 복잡한 분자에는 사용되지 않습니다. 화합물의 분자 공식은 화합물이 이진 화합물, 3 차 화합물, 4 차 화합물인지 또는 더 많은 원소인지를 결정하는 데 사용될 수있다.
.필요한 세부 사항이 제공 될 때 화합물의 분자식을 찾을 수 있습니다. 다음 예는 분자식을 찾는 방법을 보여줍니다.
질문 :
c =40%, h =6.72% 나머지는 산소이며, 화합물의 분자량은 180 g/mol로 발견됩니다.
.답변 :
존재하는 요소는;
입니다 c =40%
h =6.72%
o =(100- {40+6.72})%=53.28%
화합물의 100g에 존재하는 각 원소의 두더지의 수;
c =40g/12gmol-1 =3.33 mol
h =6.72g/1gmol-1 =6.72 mol
o =53.28g/16gmol-1 =3.33 mol
이 요소들 사이의 가장 간단한 비율은 각 값을 그들 중 가장 큰 값으로 나누어 찾을 수 있습니다.
c =3.33 mol / 6.72 mol =½
h =6.72 mol / 6.72 mol =1
o =3.33 mol / 6.72 mol =½
이 원자들 사이에서 가장 간단한 정수 비율을 찾으십시오.
c =½ x 2 =1
h =1 x 2 =2
o =½ x 2 =1
따라서, 화합물의 경험적 공식은 ch 2 이다 o.
이 경험적 공식을 사용하여 분자식을 찾으려면 먼저 화합물에 존재하는 경험적 공식 유닛의 수를 찾아야합니다.
경험적 공식의 어금니 질량 =ch2o =(12 g/mol) + (1g/mol x 2) + (16g/mol)
=30 g/mol.
화합물에 존재하는 경험적 공식 장치의 수 =180 gmol-1 /30 gmol-1 =6
그러면 화합물의 분자식에 경험적 공식에 6을 곱하여 얻을 수 있습니다.
분자식 =(ch2o) x 6 =c6h12o6
구조 공식
화합물의 구조식은 화합물에서 원자의 배열을 나타내는 것입니다. 이 구조적 공식은 분자에 대한 많은 세부 사항을 제공하며 화합물의 특성은 이러한 세부 사항을 사용하여 예측할 수 있습니다.
구조 공식은 분자의 명칭에 사용될 수 있습니다. 이는 구조적 공식이 화합물에 존재하는 모든 기능 그룹과 상대 위치를 보여주기 때문입니다. 구조식은 또한 화합물 (예 :극성) 및 물리적 특성 (끓는점 등)의 화학적 특성을 예측하는 데 사용될 수 있습니다.
구조 공식을 제공하는 데 사용되는 방법은 거의 없습니다. 루이스 구조는 화합물에서 원자와 고독한 쌍 또는 짝을 이루지 않은 전자의 연결성을 보여줍니다. 응축 된 공식은 또 다른 유형의 구조 공식이며, 원자의 상대적인 위치를 제공하지만 이것은 그리 도움이되지 않습니다 (예 :Ch 3 ch 2 오, 에탄올의 응축 된 공식).
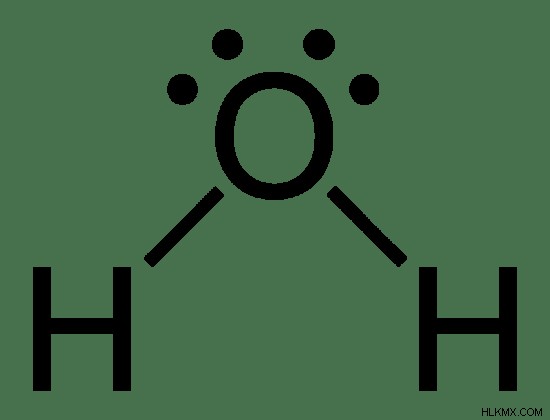
그림 1 :물 분자의 루이스 구조
유기 화학에서 중요한 유형의 구조 공식은 골격 공식입니다. 대부분의 복잡한 유기 분자는 골격 공식을 통해 제공 될 수 있습니다. 이 유형의 공식은 기능 그룹과 그 위치를 보여줍니다. 그러나 탄소 원자에 부착 된 수소 원자는 그곳에 표시되지 않습니다.

그림 2 :에틸렌 글리콜 골격 공식
입체 화학에는 여러 형태의 구조적 공식이 있습니다. 예를 들어, 구조적 공식은 화합물, 뉴먼 투영 및 유기 화합물의 톱니 투영, 설탕 분자의 피셔 투영, Haworth projection 등의 시스 트랜스 형상을 나타냅니다.
분자와 구조 공식의 차이
정의
분자식 : 화합물의 분자식 또는 화학적 공식은 원자의 유형과 해당 화합물에 존재하는 비율의 표현입니다.
구조 공식 : 화합물의 구조적 공식은 화합물에서 원자의 배열의 표현이다.
세부 사항이 주어진
분자식 : 분자식은 화합물에 존재하는 원자 사이의 비율을 제공합니다.
구조 공식 : 구조적 형식은 화합물에서 작용기의 원자와 상대적 위치를 배열합니다.
사용
분자식 : 분자 공식은 간단한 분자의 명명법에 사용되어 화합물이 이진 화합물, 3 차 화합물, 4 차 화합물인지 또는 더 많은 원소 등을 갖는지 여부를 결정할 수 있습니다.
구조 공식 : 구조 공식은 복잡한 분자의 명칭에 사용될 수 있으며 화합물 (예 :극성) 및 물리적 특성 (예 :비등점)의 화학적 특성을 예측하는 데 사용될 수 있습니다.
결론
분자식 및 구조 공식은 화합물의 실제 구조를 결정하는 데 매우 중요합니다. 분자 공식과 구조적 공식의 주요 차이점은 분자식 공식이 원자의 상대 위치를 나타낼 수 없지만 구조적 공식은 원자의 상대 위치를 나타냅니다.
참조 :
1. Helmenstine, Anne Marie. "화합물 경험적 및 분자 공식 계산." Thinkco, 2017 년 8 월 4 일, 여기에서 사용할 수 있습니다.
2. "2.1 :구조 공식." 화학 LibreTexts, LibreTexts, 2017 년 6 월 22 일, 여기에서 구할 수 있습니다.
이미지 제공 :
1. Commons Wikimedia
2를 통한 "Water-2D-Flat"(공개 도메인). Sander de Jong의 "Ethylene Glycol" - Commons Wikimedia를 통한 자신의 작업 (공개 도메인)







