이온화 에너지 이해
이온화 에너지는 지상 전자 상태에서 기체 원자 또는 이온에서 전자를 제거하는 데 필요한 최소 에너지입니다.
이온화 에너지에 영향을 미치는 요인
* 핵 전하 : 더 높은 핵 전하 (더 많은 양성자)는 전자에 대한 더 강한 인력을 유발하여 이온화 에너지를 증가시킵니다.
* 전자 차폐 : 내부 껍질의 전자는 핵에서 외부 전자를 보호하여 인력을 감소시키고 이온화 에너지를 낮추는 것입니다.
* 전자 구성 : 채워진 또는 반으로 채워진 서브 쉘의 전자는 더 안정적이므로 더 많은 에너지가 제거되어야합니다.
개념 적용
1. 주기적 트렌드 : 이온화 에너지는 일반적으로 기간 (왼쪽에서 오른쪽으로)을 이동하고 그룹을 아래로 이동할 때 감소합니다 (위에서 아래로).
2. 요소 분석 :
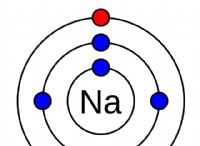
* na (나트륨) : 단일 원자가 전자로 인한 그룹 1, 낮은 이온화 에너지.
* al (알루미늄) : 3 개의 원자가 전자로 인해 NA보다 높지만 Si 및 Cl보다 낮은 그룹 3.
* si (실리콘) : 그룹 4, Al보다 높지만 S 및 Cl보다 낮습니다.
* s (황) : 그룹 6, SI 및 AL보다 높고 크기가 작고 핵 전하가 더 크기 때문에 CL보다 낮습니다.
* Cl (염소) : 그룹 7, 전자에 대한 강한 보유로 인해 가장 높은 이온화 에너지.
가장 높은 이온화 에너지에서 가장 높은 내에서 가장 낮은 이온화 에너지 :
1. cl
2. s
3. si
4. al
5. na