핵심 개념
이 튜토리얼에서는 밸런스 전자 에 대해 배웁니다 , 그들이 무엇인지, 그리고 왜 중요한지. 우리는 또한 요소가 얼마나 많은 원자가 전자를 가지고 있는지 알리는 방법을 배울 것입니다.
다른 기사에서 다루는 주제
- 주기적인 테이블을 읽는 방법
- 주기적 트렌드가 쉽게 만들어졌습니다
- 이온 성 대 공유 결합
- 전자 쉘 구성
- 전자 궤도 및 궤도 형태
원자가 전자는 무엇입니까? 왜 중요한가?
원자가 전자는 원자의 가장 바깥 전자 쉘에 위치한 전자입니다. 핵에서 가장 먼 이들 전자는 원자에 의해 가장 단단히 고정 된이 전자는 결합과 반응에 참여하는 전자이다. 이것은 또한 원소가 반응성, 전기 음성 성 및 형성 할 수있는 본드 수를 결정하는 원자가 전자의 수를 의미합니다.
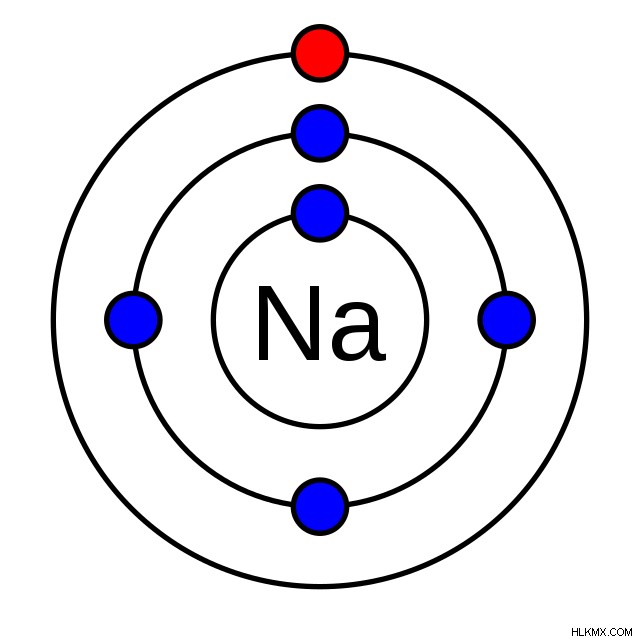
예를 들어, 나트륨 전자 구성의 단순화 된 다이어그램을 보여주는 아래 그림에서 원자가 전자는 빨간색으로 표시됩니다. 가장 바깥 쪽 껍질에 있습니다 (이 경우 쉘은 고리와 비슷합니다).
용어 원자가 다른 원자와 결합을 형성하는 요소의 능력을 말합니다. 요소의 원자가는 역사적으로 얼마나 많은 수소 원자가 결합 할 수있는 수소 원자 (본딩에 사용할 수있는 얼마나 많은 원자가 전자 수에 의해 결정됨) :예를 들어, 탄소는 ch 4 를 형성 할 수 있습니다. 따라서 원자가는 4이고 4 개의 원자가 전자가 있습니다. 한편, 질소는 nh 3 를 형성 할 수있다 그래서 그것은 3의 원자가와 3 개의 원자가 전자를 가지고 있습니다.
요소는 몇 개의 원자가 전자를 가지고 있습니까?
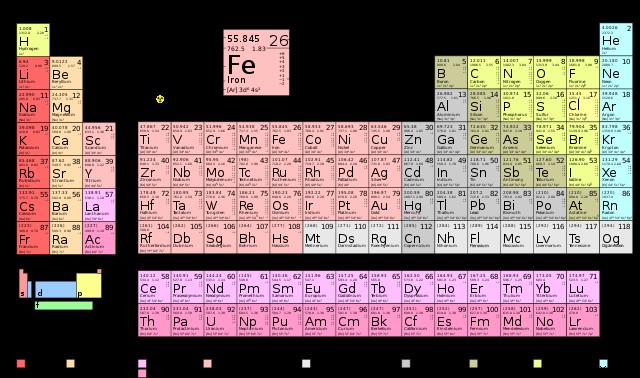
주기적인 테이블을 사용하여 원소의 원소 (특히 요소의 중립 원자)가 얼마나 많은 원자가 전자 수를 결정하는 데 도움이 될 수 있습니다. 그룹 을보십시오 그룹 번호가 요소가 가진 원자가 전자의 수를 나타내는 요소가 있습니다.
그러나이 규칙은 금속 전이가 아닌 요소에만 적용됩니다. 전이 금속은 더 복잡한 전자 구성을 가지고 있습니다. 따라서 요소의 특정 전자 쉘 구성을 살펴보고 파악해야합니다.
이것은 또한 그룹 번호를 볼 때 전이 금속을 제외한다는 것을 의미합니다. 그것들은 주기율표의 중간에있는 블록에 있습니다. 이런 의미에서 아래의 아래 다이어그램에서 그룹 1과 2는 동일하게 유지되지만 그룹 13은 새로운“그룹 3”이지만 그룹 14는 새로운“그룹 4”등입니다.
예제
예를 들어, 나트륨은 그룹 1에 있으며, 하나의 원자가 전자가 있음을 나타냅니다. 이를 확인하기 위해 전자 쉘 구성 (1S2S2P3)을 확인할 수 있습니다. 우리가 볼 수 있듯이, 3S 궤도에는 하나의 전자가 있습니다.이 전자는 가장 바깥 쪽입니다.
또 다른 예는 염소의 예입니다. 염소는 그룹 7에 있으며, 7 개의 원자가 전자가 있음을 나타냅니다. 이를 확인하기 위해 전자 쉘 구성 :1S2S2P3S3P를 살펴볼 수 있습니다. 우리가 볼 수 있듯이, 3S 및 3P 궤도에는 7 개의 전자가 결합되어 있으며, 이는 가장 바깥 세 번째 궤도를 구성합니다.
마지막으로, 우리는 그룹 4에있는 탄소를 살펴볼 수 있습니다. 이것으로부터, 우리는 그것이 원자가 쉘에 4 개의 전자를 가지고 있다고 추론합니다. 확인하기 위해 전자 쉘 구성 (1S2S2P)을 확인합니다. 우리가 볼 수 있듯이, 2s 및 2p 궤도에는 4 개의 전자가 결합되어 있으며, 이는 가장 바깥 쪽 두 번째 궤도를 구성합니다.
주목할만한 경우는 그룹 8의 경우입니다.이 그룹의 요소에는 8 개의 전자가 있으며 이는 전체 옥셋을 만듭니다. 귀족 가스 로 알려진 이러한 요소를 특별하게 만듭니다. . 전자 쉘의 전체 옥셋이 너무 안정적이기 때문에 결합 또는 반응에 사용할 수있는 원자가 전자가 거의 없습니다.
추가 읽기
- 전기 음성
- 뉴 클레오 포블
- electrophile
- 탄수화물 안정성
- 루이스 산 및베이스