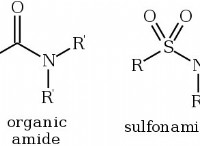
1. 플레이어 이해 :
* 금속 : 금속은 전자를 잃는 경향이 있습니다 (양이온이라고 불리는 양으로 하전 된 이온이 됨). 그것들은 이온화 에너지를 상대적으로 낮으므로 전자를 제거하는 데 많은 에너지가 필요하지 않습니다.
* 비금속 : 비금속은 전자를 얻는 경향이 있습니다 (음이온이라고하는 음으로 하전 된 이온이됩니다). 그들은 전자 친화력이 높기 때문에 전자를 쉽게 받아들입니다.
2. 전자의 춤 :
* 금속과 비금속이 함께 모인 경우 금속 원자는 하나 이상의 전자를 비금속 원자로 전달합니다.
*이 전자 전달은 두 요소 사이의 전기 음성의 차이에 의해 구동됩니다. 전기 음성은 전자에 대한 원자의 매력을 측정 한 것입니다. 비금속은 금속보다 전기 음성이 높습니다.
* 현재 전자가 누락 된 금속 원자는 양으로 하전 된 이온 (양이온)이됩니다.
* 전자를 얻은 비금속 원자는 음으로 하전 된 이온 (음이온)이된다.
3. 정전기 인력 :
* 반대의 유치! 긍정적으로 하전 된 양이온 및 음으로 하전 된 음이온은 이제 정전기력으로 인해 서로 강하게 끌린다.
* 반대로 하전 된 이온 사이 의이 강력한 정전기 인력은 이온 결합을 구성하는 것입니다.
4. 결정 격자의 형성 :
* 이온은 결정 격자라고 불리는 규칙적이고 반복되는 패턴으로 자신을 배열합니다. 이 배열은 반대로 하전 된 이온 사이의 매력을 최대화하면서 유사한 전하 사이의 반발을 최소화합니다.
예 :
* 클로라이드 나트륨 (NACL)의 형성을 고려하십시오.
* 나트륨 (NA)은 금속이며, NAIT가되기 위해 하나의 전자를 쉽게 잃게됩니다.
* 염소 (CL)는 비금속이며, 하나의 전자를 쉽게 얻어 Cll이됩니다.
* Na⁺와 Cl⁻ 사이의 정전기 인력은 이온 성 결합을 형성하여 염화나트륨의 결정 구조를 형성합니다.
키 포인트 :
* 이온 성 결합은 일반적으로 강한 결합으로, 이온 성 화합물에 대한 높은 용융 및 끓는점을 초래한다.
* 이온 성 화합물은 일반적으로 실온에서 고체입니다.
* 물 분자는 이온을 둘러싸고 분리 할 수 있기 때문에 종종 물에 용해됩니다.
다른 질문이 있으면 알려주세요!