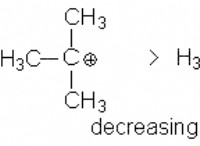
1. 두더지의 가장 간단한 전체 수치 비율을 찾으십시오 :
* 각 두더지 값을 가장 작은 두더지 값 (0.035 mol n)으로 나눕니다.
* C :0.175 mol / 0.035 mol =5
* H :0.140 mol / 0.035 mol =4
* n :0.035 mol / 0.035 mol =1
2. 경험적 공식 :
* 가장 간단한 전체 수치 비율은 우리에게 경험적 공식을 제공합니다.
3. 경험적 공식 질량을 계산하십시오 :
* (5 x 12.01 g/mol c) + (4 x 1.01 g/mol H) + (1 x 14.01 g/mol n) =80.09 g/mol
4. 분자식을 결정하십시오 :
* 분자 질량을 경험적 공식 질량으로 나눕니다 :160 g/mol/80.09 g/mol ≈ 2
*이 요인에 의해 경험적 공식의 위시를 곱하십시오.
따라서 화학식의 첨자는 탄소의 경우 10, 수소의 경우 8, 질소의 경우 2입니다.