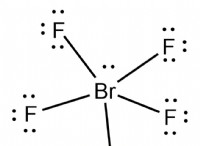
개념 이해
* 전기 음성 : 이것은 원자가 결합으로 전자를 유치하는 경향입니다. 전기 음성이 높을수록 전자를 더 강하게 당기는 것을 의미합니다.
* 전자 친화력 : 이것은 원자가 전자를 얻을 때 에너지의 변화입니다. 더 부정적인 전자 친화력은보다 유리한 에너지 변화 (전자의 더 큰 인력)를 나타냅니다.
* 산화제 : 산화제는 전자를 얻어 다른 종의 산화 (전자 손실)를 유발합니다.
주요 차이 :
불소는 전기성이 높지만 전자 친화력은 실제로 염소의 보다 부정적인 * . 이 모순 된 진술은 불소가 더 강한 산화제 인 이유를 이해하는 열쇠입니다.
* 전기 음성도는 본드 내에서 전자 *의 매력을 설명합니다. 결합에서 불소의 높은 전기성은 전자를 강하게 끌어 당기는 것을 의미합니다.
* 전자 친화력은 전자가 * 음이온 * (음으로 하전 된 이온)을 형성하기위한 인력을 설명합니다. . 불소는 전자에 대해 강한 친화력을 가지고 있지만 음이온을 형성하는 데 염소의 친화력이 약합니다.
이것이 플루오린을 더 강한 산화제로 만드는 이유 :
* 작은 크기 : 불소는 염소보다 작습니다. 이는 전자가 핵에 더 가깝고 더 큰 인력을 경험 함을 의미합니다. 이는 불소 함유 화합물에서 더 강한 결합으로 이어진다.
* 결합 강도 : F-F 결합의 강한 결합 강도는 플루오린이 염소에 비해 약간 덜 유리한 전자 친화력으로도 전자를 얻고 F 사이안 이온을 더 쉽게 할 수있게한다.
* 형성의 엔탈피 : 불소는 염소 (Cl⁻)에 비해 할라이드 이온 (F⁻)에 대한 더 부정적인 엔탈피를 갖는다. 이는 Fing 형성이 더 많은 에너지를 방출하여 반응을 더 유리하게 만듭니다.
요약 :
불소의 낮은 전자 친화력은 그것이 약한 산화제, 더 작은 크기, 더 강한 결합 및 F⁻에 대한 더 많은 음성 엔탈피임을 암시하는 것처럼 보일 수 있지만, 염소보다 훨씬 더 강한 산화제가된다.