할로겐은 주기율표의 그룹 7에 속하는 요소입니다. 할로겐 패밀리는 불소, 염소, 브로민, 요오드, 아스타틴 및 테네시로 구성됩니다. 할로겐은 전자를 수용하는 여유 공간으로 인해 1의 원자가가 1입니다. 외부 껍질의 공석으로 인해 엄청나게 전기 음성이 있습니다. 할로겐은 그들 사이에 공유 결합이있는 interhalogen 화합물을 형성하기 위해 그들 내에서 반응하는 경향이있다.
그러한 화합물 중 하나는 브롬 펜타 플루오 라이드입니다. 브롬 펜타 플루오 라이드의 혼성화는 원자의 다른 하이브리드 화 과정과 마찬가지로 다른 에너지와 다양한 형태의 하이브리드 궤도를 형성한다.
하이브리드 화 :무슨 뜻입니까?
-
하이브리드 화는 일반적으로 두 가지를 혼합하는 것을 의미하며, 이는 하이브리드라는 새로운 제품을 초래합니다.
-
화학에서, 혼성화는 두 개의 원자의 궤도에 대한 아이디어를 말해서 부모의 요소와 다른 에너지, 모양 및 특성을 갖는 새로운 궤도를 형성합니다.
할로겐
halogens는 그룹 7에 따라주기적인 테이블에서 자리를 차지합니다. 그들의 이름은 소금 형성의 특성을 나타냅니다. 할로겐 패밀리는 F, Cl, BR, I, AT 및 아마도 TS로 구성됩니다.
할로겐의 특성
할로겐은 일반적이고 일반적인 물리적, 화학적 특성을 가지고 있습니다. 그것들은 일반적으로 호모 핵 규조토로 존재합니다.
크기
-
그룹의 원자 수를 가진 첫 번째 할로겐 불소는 전자 구성 2,7의 원자에 2 개의 궤도가 있습니다.
-
그룹 아래로 이동할 때 원자에 추가 궤도가 추가됩니다.
-
따라서 할로겐의 크기는 그룹을 낮추게됩니다.
밸런스
-
모든 할로겐은 원자가 쉘에 전자를 첨가하기위한 여유 공간을 가지고 있습니다.
-
따라서 할로겐의 원자가는 항상 1입니다.
전기 음성
-
원자가 쉘에서 하나의 전자를 가져 오는 능력으로 인해 전기 음성 작용을합니다.
-
전기 음성 속성은 다운 이동시 크기가 증가하여 그룹을 감소시키는 경향이 있습니다.
브롬 펜타 플루오 라이드
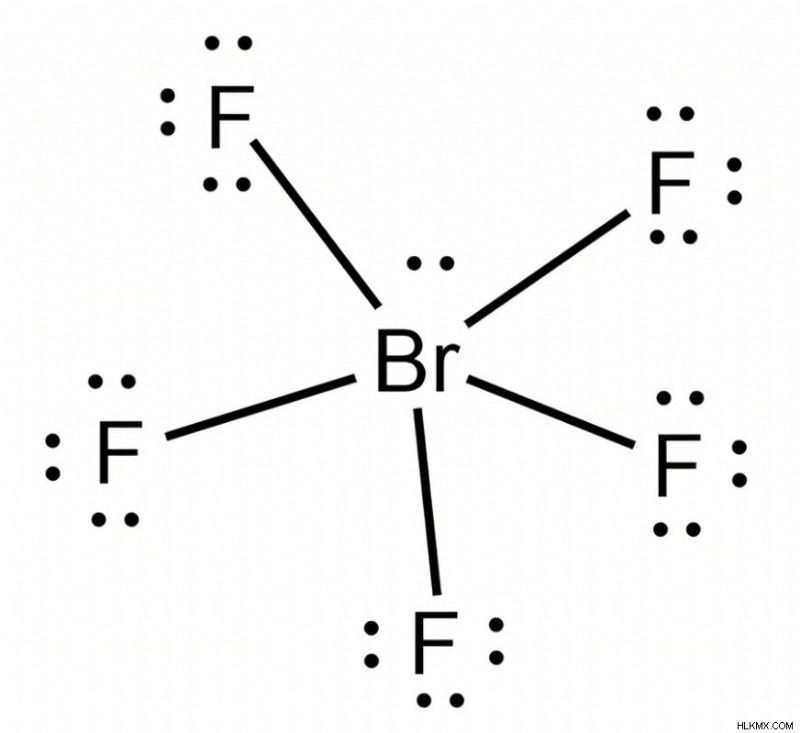
Bromine Pentafluoride, Brf5는 펜타 발렌트 브롬 원자로 인해 형성된 삽화 화합물입니다. 분자는 반응성이 높고 증기 형태로 피부, 눈 및 점막을 자극합니다.
브롬의 전자 구성
-
Bromine의 원자 번호는 35입니다.
-
[ar] 4S23D104P5의 전자 구성이 있습니다.
불소의 전자 구성
-
불소 원자 번호는 9입니다.
-
[HE] 2S22P5의 전자 구성이 있습니다.
-
하나의 불소 원자는 원자가 쉘에서 하나의 전자 쌍을 잃어버린 브롬 원자에서 한 쌍의 전자를 받아 들일 수 있습니다.
-
따라서, 5 개의 불소 원자는 펜타 발렌트 브롬 원자와 결합하여 하이브리드 화 된 브롬 펜타 플루오 라이드 분자를 초래합니다.
궤도의 전자
궤도는 전자가 주로 원자에서 발견되는 3D 공간입니다. 궤도는 일반적으로 두 개의 전자를 담을 수 있습니다.
-
S 궤도는 2 개의 전자를 유지할 수 있습니다.
-
p 궤도는 각각 2 개의 전자를 포함하는 px, py 및 pz로 나뉘어 있기 때문에 6 개의 전자를 담을 수 있습니다.
-
d 궤도는 dxy, dyz, dxz, dx2-y2 및 dz2로 세분되기 때문에 최대 10 개의 전자를 유지할 수 있습니다.
-
각 궤도는 두 개의 전자를 보유합니다. 따라서 총체적으로 D 궤도는 최대 10 개의 전자를 유지합니다.
-
f 궤도는 14 개의 전자를 유지할 수 있습니다.
브롬 펜타 플루오 라이드의 혼성화
-
브롬 펜타 플루오 라이드의 혼성화는 SP3D2의 궤도 구성을 초래합니다.
-
혼성화는 분자의 정사각형 피라미드 모양을 초래합니다.
-
일반적으로 브롬 전자 구성은 1S2 2S2 2P6 3S2 3P6 3D10 4S2 4P5입니다.
-
그러나 펜타 불행 구조를 얻으려면 원자에는 5 개의 자유 전자가 있어야합니다.
-
그래서 4p5에서 4D 궤도로 이동하여 5 개의 고독한 전자 쌍의 전자가 발생합니다.
-
시프트는 4p 궤도의 반으로 가득 찬 구성을 선호하여 더 안정적입니다.
-
4D 궤도의 5 개의 궤도 중 하나를 채워집니다.
-
따라서 5 개의 불소 원자는 브롬 원자와 결합 된 하나의 고독한 전자 쌍을 받아 들일 수 있습니다.
-
따라서, 그들의 궤도는 하이브리드 화를 통해 혼합되어 분자의 하이브리드 모양을 형성합니다.
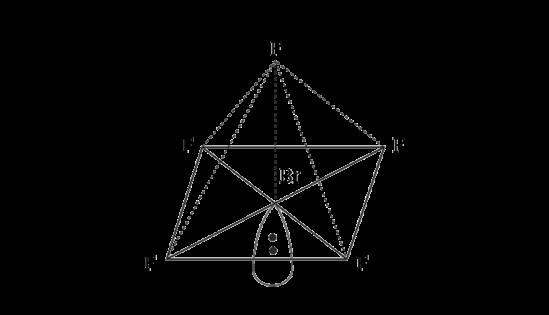
Bromine Pentafluoride - 사각형 피라미드 구조
-
겹치는 정면 머리에 브롬 펜타 플루오 라이드는 불소와 5 개의 시그마 브로민 결합을 형성합니다.
-
불소 펜타 플루오 라이드의 혼성화로 인해 형성된 제곱 피라미드 구조에서 중심 원자를 가진 불소 원자 사이에 형성된 결합의 각도는 90 °입니다.
-
중앙 브롬 원자에 한 론 전자 쌍이 존재합니다.
브롬 펜타 플루오 라이드의 응용
-
Bromine Pentafluoride
-
일반적으로 로켓 추진제에서 산화제 역할을합니다.
-
우라늄을 우라늄 헥사 플루오 라이드로 변환하는 데 산화제 중 하나로 관여합니다.
-
플루오로 카본 합성에 도움이됩니다.
결론
브롬 펜타 플루오 라이드의 하이브리드 화는 화학 분자 브로민 펜타 플루오 라이드에 대한 모든 세부 사항을 제공합니다. 그것은 펜타 발렌트 브롬과 5 개의 불소 원자 사이의 공유 결합으로 인해 형성된 하이브리드 분자이며, 한 쌍의 전자가 결여되어있다. 그것은 반응성이 높고 화학 공정 및 상업용 로켓 추진제에 산화제로 사용됩니다.
브롬 펜타 플루오 라이드의 혼성화는 SP3D2 하이브리드 화를 형성하여 사각형 피라미드 분자 구조를 초래한다. 하이브리드 분자는 공유 전자 공유로 인한 6 개의 시그마 결합 및 약 90 °의 결합 각도를 갖는다. 혼성화가 발생하기 위해, 브롬의 4p 궤도에서 4D 궤도로 이동하는 2 개의 전자가 4D 궤도로 이동합니다.