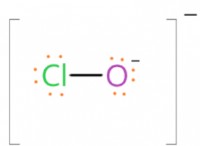반응 :
hypo (NaClo)와 염산 (HCL) 사이의 반응은 염소 가스 (CL), 물 (HATE) 및 염화나트륨 (NACL)을 생성합니다.
NaClo + 2HCl → Cl₂ + H₂O + NaCl
온도 및 반응 속도 :
* 온도 증가 :
* 운동 에너지 증가 : 온도가 높을수록 분자는 더 빨리 움직이고 더 자주 충돌합니다. 이는 더 성공적인 충돌로 이어지는데, 이는 반응이 발생하는 데 필요한 활성화 에너지 장벽을 극복하기에 충분한 에너지와의 충돌을 의미합니다.
* 충돌 빈도 증가 : 동역학 에너지가 높으면 분자가 더 자주 충돌하여 성공적인 충돌 가능성이 높아집니다.
* 더 빠른 반응 속도 : 이러한 요인의 결과로, 온도가 증가함에 따라 전체 반응 속도가 급격히 증가합니다.
이것을 관찰하는 방법 :
* 실험적으로 : 다른 온도에서 반응을 수행 하여이 효과를 관찰 할 수 있습니다. 염소 가스 생산 속도 (버블 링 속도로 표시)는 더 높은 온도에서 더 빠릅니다.
* 안전 예방 조치 : 이 실험을 수행 할 때 매우 조심하십시오. 염소 가스는 독성이 있으며 통풍이 잘되는 지역에서만 처리해야합니다.
키 포인트 :
* 활성화 에너지 : 활성화 에너지는 반응물이 반응하는 데 필요한 최소 에너지입니다. 더 높은 온도는이 장벽을 극복하기 위해 필요한 에너지를 더 많이 제공합니다.
* 충돌 이론 : 충돌 이론은 반응이 발생하기 위해서는 분자가 충분한 에너지와 올바른 방향과 충돌해야한다고 명시하고있다. 온도는 두 요인에 영향을 미칩니다.
결론 :
온도는 hypo와 희석 염산 사이의 반응 속도에 유의 한 긍정적 인 영향을 미칩니다. 온도가 증가하면 운동 에너지 증가, 충돌이 더 자주 발생하며 충돌 가능성이 높아서 반응 속도가 빠릅니다.