금속 또는 비금속과 반응 할 때 산소는 일반적으로 산화물을 형성합니다. 다른 산화물과 마찬가지로, 산소가 할로겐 패밀리와 반응 할 때 옥시 산 또는 옥시 야신에 대한 것입니다. 할로겐 패밀리 외에, 그것은 붕소, 질소, 황 및 인으로 옥시 야신을 형성 할 수 있습니다. 할로겐의 옥소 세포는 4 가지 형태, 즉 저혈산 (hox), halous acid (hoxo), 할산산 (hoxo 2 형태로 존재합니다. ) 및 Perhalic acid (Hoxo 3 ). 이러한 방식으로, +1 산화 상태를 갖는 염소의 옥소 세이드는 차아 염소산 (HOCL)이다. 이온 성 형태로, 그것은 차아 염소산염 (CLO) 이온으로 존재한다. 그러나이 차아 염소산염 이온이 모노바스산 이외의 다른 주요 차아 염소산염을 형성 할 수 있다는 것을 알고 있습니까? 이 기사를 살펴보고 차아 염소산염 및 이온과 그 용도 및 특성에 대해 자세히 알아 보겠습니다.
차아 염산염 이온이란 무엇입니까?
차아 염소산염은 할로겐의 옥소 세포에서 형성된 염입니다. 그들은 차아 염소산염 이온, 즉 클로 이온을 함유한다. 특정 양이온이 이들 차아 염소산염 이온에 부착되면, 이들은 상이한 차아 염소산염 산염을 형성한다. 가장 일반적이고 단일 염소산염 산식 공식은 HCLO이며, 차아 염소산으로도 알려져 있습니다.
차아 염소산 나트륨 (NaClo), 칼슘 차아 염소산염 [Ca (CLO)
차아 염소산염의 병력
1789 년에 차아 염소산염은 프랑스 창 던지기에서 처음 생산되었습니다. 탄산나트륨 용액에 걸쳐 염소 가스를 통과시켜 생성되었습니다. 생성 된 액체는 장화수 또는 au de javelle로 알려진 약한 나트륨 차아 염소산염 용액이었다. 그러나 효율적이지 않았으므로 화학자들은 다른 제조 방법을 찾았습니다. 19 세기, E.S. Smith는 차아 염산염을 생산하는 방법을 생성하고 특허를 받았습니다. 그의 과정에 따르면 소금물은 염소 가스와 가성 소다를 생산하기 위해 가수 분해됩니다. 그 후, 그들은 차아 염소산염을 형성하기 위해 혼합됩니다. 오늘날이 방법의 개선 된 버전이 Hooker 프로세스라고 알려진 사용됩니다. 이 과정은 차아 염소산 나트륨 생성의 유일한 대규모 산업 방법입니다.
차아 염소산염 이온의 구조 및 기하학
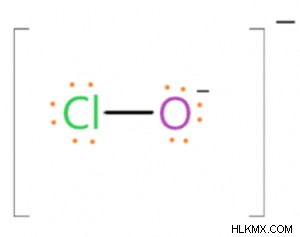
차아 염산염 이온은 하나의 음전하를 가지므로, 하나의 음으로 하전 된 산소 원자를 함유한다. 이 O- 원자는 1가이며 단일 결합, 즉 (Cl-O) 𝜎- 본드를 통해 CL- 원자와 연결됩니다. 이 이온의 전자 점 구조는 옥트 규칙을 준수한다는 것을 보여 주며, 그 안에서 Cl-atom은 O-Atom과 하나의 결합으로 연결되며 3 개의 고독한 쌍이 있습니다. 따라서, Cl-Atom은 하나의 결합 및 3 개의 고독한 쌍으로 둘러싸여 있기 때문에,이 원자는 SP3 혼성화된다. Cl-atom의 하이브리드 화 된 궤도는 O 이온 및 형태 (Cl-O)의 하이브리드 화 된 궤도와 겹친다. Cl-Atom에 3 개의 고독한 쌍이 존재하기 때문에 Clo Ion은 사면체 형상이 없지만 선형 모양을 갖습니다. 클로 이온의 Cl-O 결합 거리는 1.69Å이고 Cl-O 결합 에너지는 209 kJ/mol입니다.
차아 염소산염 제조
1. 알칼리 또는 알칼리성 지구 금속과의 반응 수산화물 :
차아 염소산염 산염은 염소를 알칼리 또는 알칼리성 지구 금속과 수산화물과 반응 할 때 생산됩니다.
cl 2 + 2NAOH → NaCl + NaClo + H 2 o
2Cl 2 + 2ca (OH)
이러한 반응은 염소산염의 형성을 억제하기 위해 실온 근처에서 수행됩니다.
2. 전기 화학적 과정에 의해 :
이 과정에서 소금물은 전기 분해되어 cl 2 를 형성합니다 , 차아 염소산염을 형성하기 위해 물에 분리됩니다.
2Cl → Cl 2 + 2e
cl 2 + h 2 o cl hclo + cl + h
3. 금속 황산염과의 반응 :
차아 염소산 칼슘이 금속 황산염과 반응하면 금속 차아 염소산염과 황산 칼슘을 생성합니다. 이 반응은 물에서 수행됩니다.
ca (clo)
차아 염소산염 이온의 특성
특성에 따라 특성은
로 분류됩니다1. 물리적 특성 :
- 염소의 옥소 세이 이온의 IUPAC 이름은 차아 염소산염입니다.
- 차아 염소산염 산 공식은 clo. 입니다
- 차아 염소산염의 분자량은 51.449 g/mol. 입니다
- 그것은 견고하고 40 ° C에서 분해됩니다.
- 그것은 물에 용해됩니다.
- 차아 염소산 (HCLO)은 컨쥬 게이트 산입니다.
- 염소 산화물, 염소 옥소아니온 및 1가 무기 음이온입니다.
- 섭취 및 흡입 에 의해 독성이 있습니다
2. 화학적 특성 :
- 산성화에서 차아 염소산염은 차아 염소산을 제공합니다. 이 반응은 염소 가스와 평형에 존재합니다.
2H + Clo + Cl clo Cl 2 + h 2 o
- 가열시, 차아 염소산염은 염화물, 산소 및 기타 염소산으로 끊어집니다.
2Clo cl 2cl + o 2
3Clo cl 2cl + clo 3
- 그것은 매우 불안정하고 솔루션 형태로만 존재할 수 있습니다.
- 칼슘 차아 염소산염은 안정성이 우수하며 산업 규모로 생산됩니다.
- 순수한 마그네슘 차아 염소산염을 제조 할 수 없습니다.
- 가열시, liocl 및 ca (OCL)
2 위험한 열 런 어웨이로 이어지고 폭발 할 수 있습니다. - 차아 염소 나트륨의 희석액은 안정적이며 가정 표백제로 사용됩니다.
- anhydrous liocl은 실온에서 안정적이며 Naocl은 0 ° C 이상으로 불안정합니다.
- 차아 염소산 단독만이 염소를 생산하기 때문에 분리되어 불안정합니다.
- 암모니아와의 반응에서 차아 염소산염은 다음과 같은 제품을 제공합니다.
nh 3 + clo → HO + NH 2 cl
nh 2 cl + clo → Ho + nhcl 2
nhcl 2 + clo → Ho + ncl 3
차아 염소산염의 사용
중요한 차아 염소산염 산 용도는 다음과 같습니다.
- 유기 화학에서 1 차 알코올을 카르 복실 산으로 산화시킵니다.
- 차아 염소산염은 염소 화 제로 사용됩니다. 또한 전자가 풍부한 아로마 탄화수소를 염색 할 수도 있습니다.
- Jacobsen 에폭시 화 반응에서 Mn (III)을 Mn (V)로 전환하는 데 도움이됩니다.
- 강력한 산화제이기도합니다.
- 차아 염소산 나트륨 (NAOCL) 및 칼슘 차아 염소산염 [CA (OCL)
2 ]는 옷을 희게하는 데 사용됩니다. - 얼룩 제거제로 사용됩니다.
- 이온은 수처리 제로 작동됩니다.
- Naocl은 유제품, 수도 공급 및 하수 처리에서 소독제이며 탈취제입니다.
- 차아 염소산염은 모발 색을 밝히는 데 사용됩니다.
- Hocl은 종이 펄프 등을 표백하는 데 사용됩니다.
- 주택에서 물을 청소하는 데 사용됩니다.
- 차아 염소산염 이온의 주요 사용법은 소독 및 표백 재료를위한 것입니다.
- 그것은 다양한 소아염의 주요 구성 요소 중 하나입니다.
- 산업적으로는 표백으로 작동하고 나쁜 냄새를 제거하며 표면 정화를 수행합니다.
- 차아 염소산염은 페놀을 클로로 페놀로 전환시키는 데 사용됩니다.
- 나트륨 차아 염소산 나트륨 용액은 종이 펄프, 리넨, 면화, 레이온 및 황마를 표백하기 위해 섬유 산업에서 액체 표백제로 사용됩니다.
차아 염소산염으로 인한 건강 위험
많은 차아 염소산제 사용이 있지만 매우 반응성이 높고 부식성 특성이 있기 때문에 많은 건강 문제를 일으 킵니다. 그들 중 일부는 다음과 같습니다.
- 차아 염소산염은 흡입 및 섭취하면 독성이됩니다.
- 그것은 눈, 소변 분비 막 및 피부를 자극합니다.
- 소량의 가정 표백제 섭취는 위장 자극을 유발할 수 있습니다.
- 높은 농도의 가정 표백제 섭취는 목, 천공, 입, 위 및 식도, 출혈 및 결국 사망에 심각한 부식성 부상을 일으킬 수 있습니다.
- 유기 물질에 근접하여 화염으로 터질 수 있습니다.
- 고농도의 차아 염소산염 용액과의 접촉은 염증, 화상 통증 및 피부에 물집을 유발할 수 있습니다.
- 활발하고 반응적인 본질은 연소를 향상 시키거나 폭발을 일으킬 수 있습니다.
- 낮은 수준의 차아 염소산염에 대한 장기 노출은 피부 자극을 유발할 수 있습니다.
결론
차아 염산염 이온은 주변 환경에 매우 민감하며 대부분 용액 형태의 안정적인 화합물을 형성합니다. 그것은 알칼리와 알칼리성 지구 금속 소금 형태에 존재합니다. 차아 염소산 나트륨, 차아 염소산 칼슘, 칼슘 클로로 클로 코 로이트 및 차아 염소산은 일반적으로 발견 된 차아 염소산염 산염 형태입니다. 주로 가정 업무에 대한 소독제 및 다양한 목적을위한 표백제로 사용됩니다. 여러 가지 방법과 다른 산업에서 사용됩니다. 그러나 눈 자극, 피부 화상, 물집, 독성과 같은 많은 건강 위험이 발생하며 사망으로 이어질 수 있습니다. 차아 염소산염 이온은 반응성이 높기 때문에, 유리, 토기 또는 폴리 비닐 플라스틱 혈관에만주의를 기울이고 저장해야합니다. 또한 칼슘 또는 차아 염소산 나트륨을 함유 한 가정용 제품은 어린이의 손이 닿지 않는 안전한 위치에 저장해야합니다.
자주 묻는 질문
1. 차아 염산염 이온이 극 또는 비극성입니까?
A. Cloion은 대칭 적으로 배열 된 두 개의 원자 (즉, 염소 및 산소)를 함유하기 때문에 비극성 분자입니다. 이 때문에 양쪽에 생성 된 쌍극자 모멘트는 서로를 상쇄하여 비극성 분자로 만듭니다.
2. 차아 염소산염을 저장하기 위해 유리, PVC 플라스틱 또는 기타 특수 용기를 사용해야하는 이유는 무엇입니까?
A. 차아 염소산염은 반응성이 높으므로 니켈, 구리, 크롬, 철, 망간 및 코발트와 같은 미량 금속에 매우 민감합니다. 미량 금속뿐만 아니라 차아 염소산염도 반응하여 고무, 특정 플라스틱 및 대부분의 직물과 같은 많은 재료를 폭력적으로 공격합니다. 따라서, 그것은 특별한 유형의 선박에 보관됩니다.
3. 차아 염소산염 이온 산 또는 염기입니까?
A. 차아 염산염 이온 (CLO)은 물에 용해 될 때 하나의 양성자 (즉, H)를 받아들이 기 때문에 본질적으로 기초입니다. 결과적으로, 그것은 차아 염소산 (HCLO)을 형성합니다. 그리고 수용액에서 양성자를 받아들이는 종은 기본임을 알고 있습니다. clo + h 2 O → HCLO + OHHYPOCHLOROS ACON (HCLO)은 차아 염소산염 이온 (CLO)의 컨쥬 게이트 산입니다.