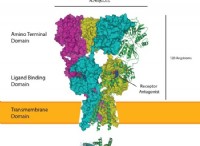
다음은 고장입니다.
* Arrhenius 이론 : 이 이론은 수용액에서의 행동에 기초하여 산과 염기를 정의합니다.
* Arrhenius 산 : 이 이론에 따르면, Arrhenius 산은 물에 용해 될 때 수소 이온 (H+)의 농도를 증가시키는 물질이다.
예 :
* 염산 (HCl) : HCl이 물에 용해되면 H+ 및 클리온으로 분리되어 H+ 농도가 증가합니다.
* 질산 (HNO3) : 유사하게, HNO3는 물의 H+ 및 NO3 이온으로 분리된다.
* 황산 (H2SO4) : 이 산은 물에 용해 될 때 분자 당 2 개의 H+ 이온을 방출합니다.
키 포인트 : 용액에서 수소 이온 (H+)의 존재는 Arrhenius 산의 정의 특성이다.