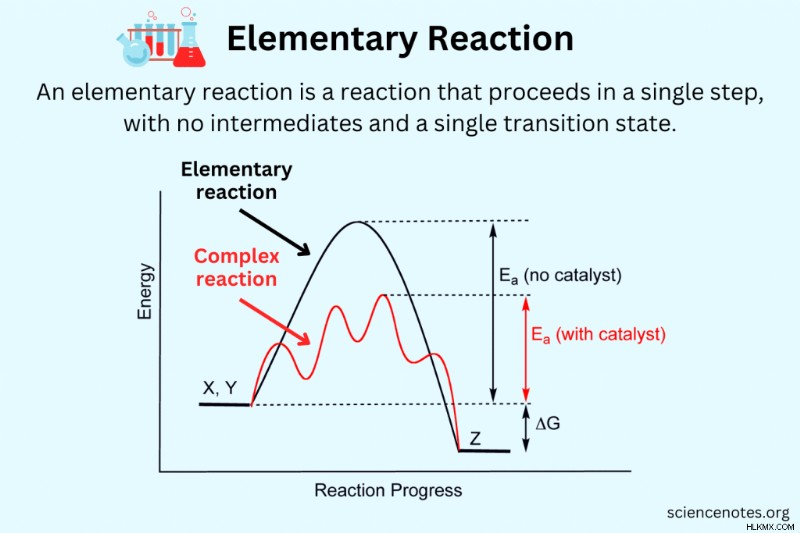
화학에서 기본 반응 하나의 전이 상태 (반응물 → 생성물)만으로 단일 단계에서 진행되는 화학 반응입니다. 기본 반응은 더 간단한 반응으로 분해 될 수 없으며 일반적으로 중간체가 없습니다. 대조적으로, 복잡한 반응 또는 비 원소 반응 또는 복합 반응 중간체 및 다중 전이 상태가있는 다중 기본 반응 (반응물 → 중간체 → 제품)으로 구성됩니다.
기본 반응의 예
기본 반응은 화학에서 일반적입니다. 예는 다음과 같습니다.
- cis-trans 이성질체
- racemization
- 열 분해 반응 :
cuco₃ (s) → cuo (s) + co₂ (g)
2HI → H 2 + i 2
c 4 H 8 → 2 C 2 H 4 - 링 오프닝 반응
- 가스 간의 많은 반응 :
아니오 2 (g) + Co (g) → 아니오 (g) + Co 2 (g)
2NO (g) + cl 2 (g) → 2nocl (g) - 방사성 붕괴
- 친 핵성 치환
기본 반응의 유형
기본 반응을 분류하는 한 가지 방법은 분자에 따른 것입니다. 분자 화학 반응에 관여하는 반응물 입자의 수를 나타냅니다. 우리는 전체 원자 또는 분자에 대해 이야기하고 있기 때문에 분자는 단 분자 (1), 이분자 (2) 또는 기기 (3)의 정수 값을 갖습니다. 용기 반응은 드물다. 4 개 이상의 분자와 관련된 알려진 기본 반응이 없습니다.
다음은 기본 반응의 유형, 분자 및 금리 법칙을 요약하는 표입니다.
| 분자 | 기본 단계 | 요율 법률 | 예 |
|---|---|---|---|
| 비 일방형 | → 제품 | rate =k [a] | n 2 o 4 (g) → 2no |
| 이질성 | a + a → products | rate =k [a] | 2nocl → 2no (g) + cl 2 (g) |
| 생체 분자 | a + b → 제품 | rate =k [a] [b] | co (g) + no 3 (g) → 아니오 <서브> 2 (g) + Co 2 (g) |
| Termolecular | a + a + a → 제품 | rate =k [a] | |
| Termolecular | a + a + b → 제품 | rate =k [a] [b] | 2no (g) + o 2 (g) → 2no |
| Termolecular | a + b + c → 제품 | rate =k [a] [b] [c] | o (g) + o 2 (g) + m → o 3 (g) + m |