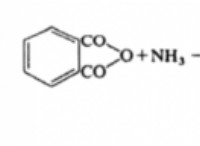
이유는 다음과 같습니다.
* 산화 및 환원 : 이들은 항상 함께 발생하는 두 가지 기본 프로세스입니다. 산화는 전자의 손실을 포함하는 반면 감소는 전자의 이득을 포함합니다.
* 산화 환원 반응 : 산화 및 감소가 동시에 발생하는 반응을 산화 환원 반응이라고합니다.
* 반 반응 : 전자 전달 공정을 이해하기 위해 전체 산화 환원 반응을 두 부분으로 분리합니다.
* 산화 반 반응 : 전자를 잃는 종을 보여줍니다.
* 감소 반 반응 : 전자를 얻는 종을 보여줍니다.
예 :
아연과 구리 (II) 이온 사이의 반응 :
* 전체 산화 환원 반응 : Zn (s) + cu²⁺ (aq) → zn²⁺ (aq) + cu (s)
* 산화 반 반응 : Zn (s) → zn²⁺ (aq) + 2e⁻
* 감소 반 반응 : cu²⁺ (aq) + 2e⁻ → Cu (S)
반응을 반 반응으로 분리함으로써, 우리는 어떤 종이 산화되고 있는지 (Zn) 감소하는지 명확하게 알 수 있습니다 (cu²⁺).