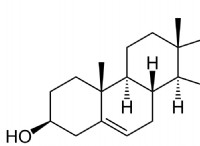
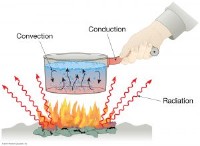
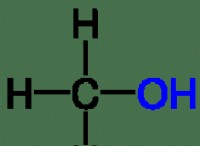
다음은 고장입니다.
* 산화 수 : 분자 또는 이온에서 원자에 할당 된 숫자는 산화 정도 (전자 손실)를 나타냅니다. 양수, 음수 또는 0 일 수 있습니다.
* 공통 산화 수 : 원소가 전형적으로 가장 안정적이거나 자주 발생하는 화합물에서 나타나는 산화 수.
왜 중요한가?
공통 산화 수를 이해하는 데 도움이됩니다.
* 화학 공식 예측 : 원소의 전형적인 산화 상태를 알면 그들이 형성 할 수있는 화합물의 가능한 공식을 예측할 수 있습니다.
* 균형 화학 방정식 : 산화 수는 전자의 전달을 포함하는 산화 환원 반응의 균형을 유지하는 데 사용됩니다.
* 반응 유형을 식별하십시오. 반응과 관련된 원소의 산화 수의 변화는 산화, 환원 또는 산화 환원 반응으로 분류하는 데 도움이됩니다.
예 :
* 산소 : 공통 산화 수는 과산화물 (-1)을 제외하고 대부분의 화합물에서 -2입니다.
* 수소 : 공통 산화 수는 히드 라이드 (여기서 -1)를 제외하고 +1입니다.
* 염소 : 일반적인 산화 수는 대부분의 화합물에서 -1이지만 CLO2 (염소)과 같은 화합물에서 양성 산화 상태를 가질 수 있습니다.
기억하십시오 :
* 공통 산화 수가 항상 요소의 유일한 산화 상태는 아닙니다.
* 일부 요소는 그들이있는 화합물에 따라 다수의 산화 수를 나타낼 수 있습니다.
* 산화 수를 결정하기위한 규칙은 관련된 요소의 전기 음성 및 결합 특성을 기반으로합니다.
공통 산화 수를 이해하면 요소의 화학적 거동을 예측하고 이해하기위한 좋은 출발점을 제공합니다.