다음은 고장입니다.
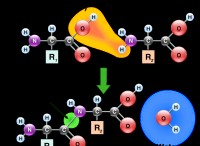
* 가스 상 : 가스 단계에서 물 분자는 멀리 떨어져 있으며 약하게 상호 작용합니다. 개별 물 분자의 쌍극자 모멘트는 주로 산소와 수소 원자 사이의 전기 음성 차이에 기인하여 산소에 대한 부분 음전하 및 수소에 대한 부분 양전하를 초래합니다.
* 액체 상 : 액체 상에서는 물 분자가 훨씬 더 가깝고 수소 결합을 형성합니다. 이들 결합은 한 물 분자의 부분적으로 양성 수소와 다른 물의 부분적으로 음성 산소 사이의 강한 정전기 상호 작용이다. 수소 결합의 형성은 효과적으로 를 향상시킨다 시스템의 전체 쌍극자 모멘트. 이는 수소 결합이 액체 내의 전체 전하 분리를 증가시키는 방식으로 물 분자를 정렬하기 때문입니다.
여기 시각적 비유가 있습니다 :
북쪽을 가리키는 단일 나침반 바늘을 상상해보십시오. 이것은 고유 한 쌍극자 모멘트가있는 기체상의 단일 물 분자와 같습니다. 이제 여러 나침반 바늘이 서로 가까이 다가 가면서 자기 힘으로 인해 같은 방향을 가리키도록 스스로 정렬한다고 상상해보십시오. 이 정렬은 수소 결합이 액체 물의 쌍극자 모멘트를 향상시키는 것처럼 더 강한 전체 자기장을 생성합니다.
키 테이크 아웃 :
* 수소 결합은 액체상에서 물의 쌍극자 모멘트에 크게 영향을 미칩니다.
* 수소 결합으로 인한 물 분자 사이의 강한 상호 작용은 기체 상에 비해 액체 상태에서 더 큰 전하 분리 및 전체 쌍극자 모멘트가 더 높아집니다.
*이 강화 된 쌍극자 모멘트는 높은 끓는점, 높은 표면 장력 및 용매 역할을하는 능력과 같은 액체 물의 독특한 특성에 중요한 역할을합니다.