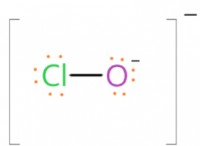1. 균형 화학 방정식 :
NAOH (AQ) + HCL (AQ) → NACL (AQ) + HATER (L)
2. 이온 방정식 :
이온 성 방정식을 쓰기 위해, 우리는 모든 가용성 이온 성 화합물을 각각의 이온으로 분리합니다.
na⁺ (aq) + OH⁻ (aq) + h⁺ (aq) + cl⁻ (aq) → na⁺ (aq) + cl⁻ (aq) + h₂o (l)
3. 순 이온 방정식 :
순 이온 방정식은 실제로 반응에 참여하는 종만을 보여줍니다. na⁺ 및 cl ⁺ 이온은 이온 방정식의 양쪽에 나타납니다. 이들은 관중 이온이며 반응 중에는 변하지 않습니다. 우리는 그것들을 취소합니다.
OH a (aq) + H⁺ (aq) → H₂O (l)
설명 :
* 수산화 나트륨 (NAOH) 강력한 기초이며, 이는 용액의 Na⁺ 및 Oh ir 이온으로 완전히 분리됩니다.
* 염산 (HCl) 강한 산으로, 용액에서 HAL 및 CLATION로 완전히 분리한다는 것을 의미합니다.
* 반응 중화 반응입니다. 염기로부터의 수산화물 이온 (OH주)은 산으로부터 수소 이온 (HAT)과 반응하여 물 (H₂O)을 형성한다.
* 염화나트륨 (NaCl) , 소금은 부산물로 형성된다. 용액에 용해 된 상태로 남아 있습니다.
키 포인트 :
* 순 이온 방정식은 반응에서 발생하는 필수 화학적 변화를 나타냅니다.
* 중화 반응은 항상 물의 형성을 포함합니다.
* 강한 염기와 강산 사이의 반응은 매우 발열이므로 열이 방출됩니다.